Dr. Borislav Zhelezarov
Clinica de reumatologie, Spitalul Universitar „Dr. Georgi Stranski”, Pleven
Lupusul eritematos sistemic (LES) este o boală eterogenă, multisistemică, autoimună, cu o gamă largă de manifestări clinice. În cursul evoluției cronice a bolii, sunt afectate aproape toate organele din corpul uman. Procesele patogenetice din LES implică interacțiuni între gene, factori de risc de mediu și celule și molecule imune care sunt implicate în apoptoză (moarte celulară programată), inițierea și modificarea răspunsului imun. Manifestările clinice sunt variabile. Evoluția LES trece prin perioade de exacerbare și perioade de activitate scăzută. Scopul tratamentului este realizarea unei remisii permanente fără manifestări clinice și de laborator ale bolii.
Cuvinte cheie: lupus eritematos sistemic, evoluție, tratament
Lupusul eritematos sistemic (LES) este o boală eterogenă, multisistemică, autoimună, cu o gamă largă de manifestări clinice. În cursul evoluției cronice a bolii, sunt afectate aproape toate organele din corpul uman. De la modificări ușoare până la amenințarea vieții în funcția lor sunt posibile, evoluția bolii include perioade de exacerbare și remisie. Diagnosticul se bazează pe anumite manifestări clinice și constatări de laborator care au apărut de-a lungul timpului, depinde mult de un istoric bun și examen clinic, deoarece nu există criterii de diagnostic specifice ca în alte boli reumatice. Au fost stabilite criteriile de clasificare pentru neurolupus și nefrită lupică. Criteriile pentru activitatea LES sunt clare.
Termenul „lupus” a fost folosit pentru prima dată în Evul Mediu pentru a descrie modificările erozive ale pielii asemănătoare unei mușcături de lup. În 1846, medicul vienez Ferdinand von Hebra a descris o „erupție de fluture” pe față, acoperind pomeții, obrajii și partea din spate a nasului. El a inventat termenul „lupus eritematos” și a publicat în 1856 o ilustrare a unui pacient afectat de boală în Atlasul bolilor pielii.
Ca boală sistemică cu manifestări viscerale, a fost caracterizată mai întâi de prof. Moritz Kaposi, confirmată de Sir William Osler la Baltimore și de prof. Joseph Jadason la Viena.
Vârsta, sexul, etnia și habitatul geografic sunt factori de risc importanți pentru debutul și rezultatul bolii.
La 65% dintre pacienți, prima manifestare a bolii este cuprinsă între 16 și 55 de ani, la 20% începe la începutul adolescenței înainte de 16 ani, iar la 15% - după 55 de ani. Raportul dintre femei și bărbați variază de la 9: 1 până la 12: 1, afro-americanii și latinii sunt mai afectați decât caucazienii.
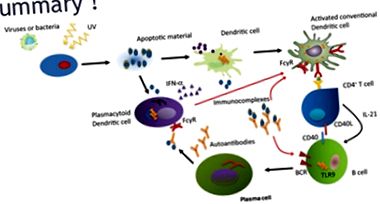
Procesele patogenetice din LES implică interacțiuni între gene, factori de risc de mediu și celule și molecule imune care sunt implicate în apoptoză (moarte celulară programată), inițierea și modificarea răspunsului imun. La indivizii predispuși genetic, factorii de risc externi (de exemplu, razele ultraviolete) acționează ca un factor declanșator pentru pierderea toleranței la autoantigeni și inducerea autoimunității. Aproximativ 40 de loci genetici sunt asociați cu apariția LES și a bolilor asemănătoare lupusului.
Există un dezechilibru atunci când numărul de celule ucise prin apoptoză crește dramatic și acest lucru duce la un răspuns autoimun anormal pentru a le distruge. Neutrofilele sunt actori cheie în proces, acționând asupra materialului nuclear, îndepărtându-l din nucleu și formând capcane extracelulare neutrofile (NET), care sunt o sursă și mai mare de antigeni care conțin acid nucleic. La rândul său, poate stimula un răspuns inflamator prin activarea receptorilor de recunoaștere exprimați de celulele imune (celule dendritice, celule T și B, macrofage), precum și de celule neimune (fibroblaste și epiteliale).
Există o pierdere a toleranței celulelor T, interacțiunii aberante a celulelor T și B, ducând la stimularea celulelor B autoreactive, diferențierea și expansiunea interleukinei 17, producând celule T, celule T reglatoare defectuoase, dezvoltarea aberantă a B -celulele care duc la întreruperea toleranței celulelor B și creșterea clonelor celulelor B autoreactive. La rândul lor, produc autoanticorpi care se leagă de autoantigeni și formează complexe imune. Ulterior, lanțul complementului este activat și provoacă inflamația structurilor țintă, cum ar fi pielea, rinichii, endoteliul vascular.
Manifestarea clinică a bolii se datorează implicării tuturor organelor și sistemelor. Simptomele variază de la manifestări nespecifice, cum ar fi oboseala și oboseala ușoară, febră slabă, erupții cutanate pe piele și față, dureri articulare și musculare, artrită, insuficiență de organ și moarte în cazuri severe și complicate.
Incidența limfomului non-Hodgkin și a altor neoplasme hematologice, precum și a carcinoamelor tiroidiene, pulmonare și hepatice, este mai mare decât în populația generală.
În ultimele două decenii, principalele îmbunătățiri în tratamentul LES sunt în direcția optimizării regimurilor de agenți imunosupresori tradiționali. În ciuda dezvoltării de noi molecule biologice și a testării acestora în studiile clinice, numai belimumab a fost aprobat pentru tratament.
Tratamentul LES are mai multe obiective:
- Răspunsul terapeutic rapid și controlul activității bolii.
- Terapie de întreținere, asigurând aderența pe termen lung a pacientului la tratamentul său și prevenind șocurile.
- Prevenirea și tratamentul bolilor concomitente, precum și a celor induse de droguri.
Glucocorticosteroizi sunt un instrument major atât pentru terapia inițială, cât și pentru debutul bolii. Doza administrată variază de la mică - 0,1-0,2 mg prednison/kg/zi. sau echivalent, moderat - 0,2-0,5 mg prednison/kg/zi/sau echivalent, până la mare - 0,5-1 mg prednison/kg/zi. sau echivalent. Alegerea depinde de tipul de afectare a organelor, doze mai mari de 1 mg/kg/zi. nu au nicio confirmare concludentă a efectului.
Administrarea intravenoasă a metilprednisolonului 500-1000 mg pe zi timp de 1-3 zile (terapia cu puls) a fost introdusă în 1970. Terapia cu pulse este extrem de eficientă la pacienții cu afecțiuni ale SNC sau cu insuficiență renală, artrită severă, pleuropericardită sau trombopenie. Majoritatea pacienților rămân la o doză mică între 2,5 și 7,5 mg prednisolon sau echivalent/zi pentru o lungă perioadă de timp. Scopul este de a lua cea mai mică doză eficientă în cel mai scurt timp posibil.
Efectele secundare ale administrării cronice a glucocorticosteroizilor în doze mari sunt un risc crescut de infecții, sindrom iatrogen Cushing, diabet steroid, risc cardiovascular crescut, miopatie, osteonecroză aseptică, osteoporoză, cataractă.
Antimalarice - sulfatul de hidroxiclorochină și clorochina sunt utilizate în mod obișnuit la pacienții cu manifestări cutanate și musculo-scheletice ale bolii.
Acestea reduc riscul de șoc, reduc deteriorarea organelor pe termen lung, reduc doza de steroid și, prin urmare, efectele sale secundare. Sulfatul de hidroxiclorochină 200-400 mg/zi este mai frecvent utilizat. Se acumulează în lizozomi și inhibă acumularea de fragmente nucleare din celulele lizate. Efectul antimalaricelor este redus prin fumat. Prevenirea lor este semnificativă în ceea ce privește accidentele tromboembolice și riscul cardiovascular, există dovezi ale densității minerale osoase îmbunătățite. Bine tolerat de către pacienți, poate fi utilizat în timpul sarcinii. Efectele lor secundare includ diaree, erupții cutanate, cardio-, mio- și retinopatie.
Agenți imunosupresori (metotrexat, azatioprină, micofenolat mofetil, ciclofosfamidă) se utilizează la pacienții cu efect insuficient al terapiei antimalarice și cu glucocorticosteroizi, cu vârfuri frecvente de LES, leziuni ale organelor, vasculită. Aportul de metotrexat 15-25 mg/săptămână/p.o. este eficient atât în manifestările articulare severe, refractare la terapia actuală, cât și în serozită, leziuni extinse ale pielii. Azatioprina se administrează la o doză mică inițială de 50 mg/zi/p.o. și titrare la 2 săptămâni în funcție de răspunsul terapeutic și evenimentele adverse de intoleranță gastro-intestinală și supresie hematopoietică. Micofenolatul de mofetil are un efect imunosupresor mai pronunțat, inclusiv în afectarea renală, decât cele două medicamente anterioare, dar și cu un efect teratogen dovedit.
Ciclofosfamida se administrează ca terapie cu impuls intravenos. Includerea sa este necesară în tratamentul refractar la terapia actuală a afectării organelor - neurolup, vasculită, nefrită lupică, poliserozită.
Terapia cu imunoglobulină intravenoasă s-a dovedit a fi eficientă în trombocitopenie și anemie hemolitică, la o doză de 1-2 g/kg zilnic timp de două zile consecutive sau 0,4 g/kg zilnic timp de cinci zile consecutive și poate fi repetată în câteva luni. Nu există un risc crescut de infecții, utilizarea imunoglobulinei este posibilă în timpul sarcinii și a sindromului antifosfolipidic.
Agenți biologici
Belimumab este un anticorp uman uman monoclonal care leagă factorul de activare a celulelor B - o citokină care stimulează
Supraviețuirea, dezvoltarea și diferențierea celulelor B în plasmocite. Este potrivit pentru utilizare în lupusul extrarenal cu apariții frecvente și activitate persistentă cu SLEDAI> 10, activitate imunologică cu scăderea C3 și C4 și titruri ridicate de ADN anti-ds pe fundalul terapiei de primă linie (corticosteroizi la o doză de peste 7,5 mg/zi și hidroxiclorochină).
Rituximab este un anticorp monoclonal himeric anti-CD20 șoarece/uman utilizat off-label la pacienții cu manifestări renale severe, hematologice și neurologice ale LES, contraindicat sau refractar la terapia cu mai mult de un agent imunosupresor sau belimumab.
Transplantul de celule stem hematopoietice și terapia cu celule stem mezenchimale alogene sunt în curs de validare.
Datorită terapiei moderne și monitorizării, supraviețuirea a crescut semnificativ și calitatea vieții s-a îmbunătățit. Răspunsul inadecvat la terapie este încă observat la aproximativ 10-20% dintre pacienți.
- Terapie sistemică Everest Ayurveda
- Rusoaică a încercat să-și vândă bebelușul pentru a cumpăra cizme - ᐉ Curios • știri despre stilul de viață
- Tsvetan Tsvetanov a dat vina pe prognozatorii vremii pentru iad în Burgas - Bulgaria
- Trigliceridele pot fi ridicate din cauza diabetului sau a unei glande tiroide bolnave
- O rusoaică a fost încoronată Miss World 2008