B. Krastev, N. Spasova, N. Georgieva, D. Somleva, A. Gudev
Clinica de Cardiologie, UMHAT „Regina Joanna - ISUL”, Sofia
Chimioterapia este o strategie terapeutică bine stabilită pentru tratamentul afecțiunilor maligne, dar eficacitatea sa clinică este adesea limitată de cardiotoxicitatea sa asociată.
Efectul cardiotoxic poate apărea rapid în timpul administrării medicamentului sau luni și chiar ani după tratament.
Prezența și severitatea diferitelor afecțiuni comorbide, precum și riscul cardiovascular crescut, nu numai că înrăutățesc prognosticul pacienților, dar limitează și opțiunile de tratament.
Pacienții cu risc crescut supuși chimioterapiei trebuie monitorizați periodic pentru deteriorarea funcției cardiace din cauza riscului de insuficiență cardiacă congestivă și a altor efecte secundare cardiovasculare. Combinația anumitor biomarkeri și parametri ecocardiografici poate fi utilizată pentru stratificarea pacienților cu predispoziție la toxicitate cardiovasculară și diagnostic precoce. Acest lucru ar conduce la inițierea la timp a tratamentului cardioprotector și ar îmbunătăți prognosticul pacientului.
Cuvinte cheie: chimioterapie, cardiotoxicitate, cardioprotecție
Datorită progreselor în diagnosticul și tratamentul bolilor neoplazice, s-au înregistrat progrese semnificative în prognosticul pacienților cu cancer în ultimele decenii, din ce în ce mai mulți oameni au supraviețuit. Potrivit Eurocare 4, 70% dintre pacienții cu cancer mamar, 80% dintre pacienții cu limfom Hodgkin și 90% dintre cei cu cancer testicular au o rată de supraviețuire de zece ani [1]. Aceste informații oferă speranță că cancerul poate fi bine controlat, similar cu diabetul și hipertensiunea.
Protocoalele optime pentru tratamentul combinat, pentru a obține un efect terapeutic pronunțat, necesită utilizarea unor doze mari de medicamente cât mai aproape de toxice. La rândul său, aceasta crește incidența efectelor secundare ale chimioterapeutice, în special cardiotoxicitatea, cu morbiditate și mortalitate cardiovasculară crescută. Cardiotoxicitatea medicamentelor împotriva cancerului depinde de factori legați de structura chimică a medicamentului, de doză, de durata cursurilor, de asocierea cu alte medicamente sau de radioterapie și de factori legați de caracteristicile pacientului (vârsta, prezența bolilor cardiovasculare și alte comorbidități) [2 ]. Leziunile cardiovasculare pot varia de la implicarea subclinică, care apare acut în timpul chimioterapiei sau cronice în decurs de unul sau mai mulți ani, până la toxicitate cardiovasculară evidentă, limitând opțiunile de tratament pentru cancer [3]. .
Diagnosticarea daunelor cardiovasculare într-un stadiu incipient este extrem de importantă pentru prognosticul pe termen lung al pacienților cu cancer.
Introducerea în practica zilnică a metodelor și markerilor prin care se diferențiază pacienții cu risc crescut și se efectuează monitorizarea lor regulată, cu scopul diagnosticului precoce și al tratamentului adecvat în timp util și adecvat, este obligatorie [4]. .
Efectele secundare cardiovasculare ale terapiei împotriva cancerului
Tulburări de conducere a ritmului
Un procent mare dintre acestea sunt asociate cu prelungirea intervalului QT de către anumite chimioterapice, acestea constituind o mare parte din inhibitorii tirozin kinazei, antibioticele antraciclinice și unele medicamente pentru tratamentul bolilor hematologice (trioxid de arsen).
Combinația acestor medicamente cu alte medicamente (cum ar fi antiemeticele utilizate adesea în practica clinică) și în prezența tulburărilor electrolitice ca urmare a pierderii crescute și a aportului redus, cresc semnificativ riscul de aritmii la pacienții cu cancer. Prin urmare, evaluarea inițială a intervalului QT este esențială în urmărirea efectelor adverse ale tratamentului. Intervalele inițiale mai mari de 460 msec pentru femei și 450 msec pentru bărbați înainte de tratament necesită monitorizare. Un semnal deosebit de alarmant este extensia sa de peste 500 msec sau modificarea valorii inițiale cu 60 msec. Acest lucru necesită controlul și înlocuirea tulburărilor electrolitice și reevaluarea atentă a terapiei [5]. .
Cele mai frecvente aritmii la pacienții cu cancer sunt fibrilația atrială și flutterul, care sunt tratate conform tuturor regulilor, ca și la alți pacienți. Factorii predispozanți sunt vârsta, comorbiditățile și tulburările electrolitice [6] .
Disfuncție ventriculară stângă este un efect secundar frecvent al chimioterapiei. Poate varia de la tulburări subclinice ale funcției diastolice la insuficiență cardiacă simptomatică rapid progresivă. În general vorbind, cardiotoxicitatea care duce la disfuncția ventriculului stâng este împărțită în două tipuri:
Tipul I - indusă de antraciclină, care este dificil de inversat.
Tipul II - indus de trastuzumab, care este reversibil la întreruperea tratamentului. Pe de altă parte, cardiotoxicitatea este împărțită în acută, care poate apărea la ore după perfuzia citostatică sau în prima lună de tratament; târziu, care apare la luni până la doi ani după chimioterapie și foarte târziu, care apare la mai mult de doi ani după încetarea tratamentului [7] .
Cea mai comună metodă neinvazivă, extrem de informativă și ușor accesibilă pentru evaluarea funcției cardiace după chimioterapie este ecocardiografia (EchoCG). Poate fi folosit pentru identificarea diferitelor forme de afectare a inimii: disfuncție ventriculară stângă (sistolică și diastolică), afectarea valvei, pericardită etc.
În 2016, Societatea Europeană de Cardiologie a publicat un aviz conform căruia cardiotoxicitatea este considerată o reducere a fracției de ejecție (EF) cu> 10 puncte procentuale la o valoare sub valoarea normală considerată, FI [8] .
Din ce în ce mai mult, tulpina și rata de încordare se bazează pe ecocardiografie pentru a cuantifica funcția miocardică și contractilitatea [9], tehnici bine validate prin sonometrometrie și imagistica prin rezonanță magnetică a inimii [10]. .
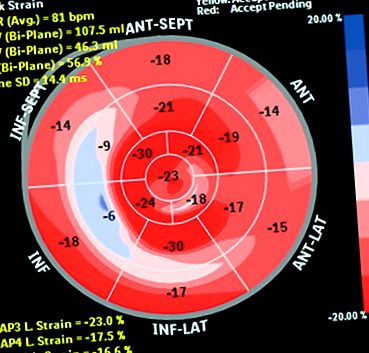
Ca rezultat al multor studii, se crede că indicatorii acestei tehnici, și anume tulpina longitudinală globală (GLS), pot fi un marker vizual al afectării timpurii, care ar oferi cea mai completă imagine a funcției sistolice a inimii (Fig. 1) [11] .
Figura 1: Evaluarea segmentelor și a GLS. Punct ochit punct lovit
Societatea americană și europeană de cardiologie a fost de acord că modificările de deformare preced reducerea fracției de ejecție a ventriculului stâng și că reducerea GLS, cu mai mult de 15% după chimioterapie, este un parametru sensibil și fiabil pentru prezicerea cardiotoxicității [12]. Cele de mai sus sunt consacrate și în recomandările Societății Europene de Cardiologie pentru monitorizarea cardiotoxicității [11]. .
Ecocardiografia Doppler tisulară este o altă metodă care oferă informații suplimentare despre relaxarea diastolică și funcția sistolică. Este o metodă importantă care ne atrage atenția asupra presiunii de umplere a ventriculului stâng și a presiunii pulmonar-capilare [13]. .
Boală coronariană este o comorbiditate frecventă la pacienții cu cancer. Motivul pentru aceasta poate fi găsit în factorii de risc obișnuiți pentru ambele boli, cum ar fi sindromul metabolic, diabetul, obezitatea, obiceiurile proaste și altele [14]. .
Având în vedere faptul că o serie de medicamente anticanceroase duc la vasospasm, disfuncție și leziuni vasculare directe, este logic să ne așteptăm ca acești pacienți să aibă un risc crescut de ateroscleroză mai timpurie și sindrom coronarian acut. Medicamentele care duc adesea la vasospasm coronarian sunt analogi pirimidinici, utilizați pentru a trata o serie de tumori gastro-intestinale și tumori maligne ale sânilor [15]. Alte medicamente, de asemenea utilizate pe scară largă în practică, analogi de platină cresc direct tromboza în vasul coronarian [16]. Prin urmare, la pacienții cu boală cardiacă coronariană/ischemică, este adecvat să discutați tratamentul cu un cardiolog și, dacă este posibil, să evitați aceste medicamente, căutând protocoale medicale alternative și regimuri mai blânde. Un fenomen comun în practică este întreruperea prematură a tratamentului cancerului, fără un efect terapeutic clar, datorită apariției unor efecte secundare semnificative. Acest lucru nu numai că limitează posibilitățile de tratament, ci și înrăutățește în mod serios calitatea vieții și prognosticul pacientului.
Se știe că radioterapia în regiunea toracică stângă este asociată cu modificări aterosclerotice precoce și mai severe, în special în artera descendentă stângă. Sindromul coronarian acut datorat ruperii plăcii aterosclerotice anterioare în timpul tratamentului sau ulterior este, de asemenea, un scenariu nefavorabil.
Utilizarea dispozitivelor moderne cu reducerea câmpurilor tangențiale de radiații și introducerea tehnicii de porți respiratorii ar putea minimiza riscul procedurii.
Leziuni valvulare reprezintă o formă de cardiotoxicitate tardivă, mai ales după radioterapie și tratament cu antracicline.
Un studiu ecocardiografic realizat de Heidenriech și colab. A arătat că 60% dintre pacienții supuși radioterapiei mediastinale pentru limfom Hodgkin au avut insuficiență aortică moderată și 15% au prezentat insuficiență aortică severă [17]. Aparatul de supapă mitrală nu este, de asemenea, scutit, iar gradul de implicare a supapei depinde și de sarcina de radiație primită cumulată.
Deteriorarea valvelor a fost raportată și cu chimioterapie [18]. .
Hipertensiune arteriala pe lângă faptul că este un factor comorbid comun, este o complicație obișnuită în timpul și după chimioterapie [19,20]. De exemplu, frecvența administrării cisplatinei variază de la 15-54% [21] .
Este demn de remarcat faptul că radioterapia pentru cancerele de cap și gât este, de asemenea, asociată cu o reglare slabă a tensiunii arteriale. Sensibilitatea baroreflexă afectată în acest caz este asociată cu creșterea tonului simpatic și parasimpatic scăzut, ceea ce duce la variabilitatea redusă a ritmului cardiac, tahicardie și afectarea vasodilatației [25]. .
Tromboembolism pulmonar
Multe studii experimentale și clinice prezintă legătura dintre cancer și hemostază. Activarea sistemică a coagulării este adesea observată la pacienții cu cancer, chiar și în absența tromboembolismului venos [26]. Activarea coagulării, în special generarea trombinei și formarea fibrinei, precum și degradarea acestora, sunt momente cheie în angiogeneza și invazia celulelor tumorale, progresia tumorii și răspândirea metastatică. Carcinomul în sine secretă adesea citokine, factori proinflamatori și alte molecule care duc la o stare procoagulantă.
Tratamentul pacienților cu tromboembolism venos stabil hemodinamic se efectuează cel mai adesea cu heparină cu greutate moleculară mică timp de 3 până la 6 luni. Anticoagularea cronică trebuie luată în considerare la fiecare pacient în funcție de raportul beneficiu/risc.
Revărsatul pericardic poate rezulta și din cardiotoxicitatea acută și cronică [29]. Radioterapia este principala cauză a acestei probleme, care reprezintă mai mult de 30% din toate formele de leziuni cardiace [3]. Revărsatul pericardic este, de asemenea, adesea rezultatul blocării neoplazice a drenajului limfatic în diferite carcinoame mediastinale. Punctul cheie este monitorizarea și prevenirea frecventă a dezvoltării tamponadei pericardice.
Alte boli vasculare sunt complicații frecvente la pacienții care primesc radioterapie și chimioterapie. Examinarea cu ultrasunete Doppler a arterelor carotide permite detectarea îngroșării mediului intima și manifestarea timpurie a bolii aterosclerotice la pacienții care au fost supuși radioterapiei capului și gâtului. O meta-analiză la 1.070 de pacienți a constatat o incidență semnificativă statistic a stenozei extracraniene, inclusiv severă la pacienții cu radioterapie comparativ cu martorii [31]. .
O serie de publicații pot fi găsite în literatura de specialitate care raportează că unele chimioterapice au toxicitate endotelială în plus față de cardio. Acesta este și motivul creșterii frecvenței accidentelor vasculare la ani după încetarea tratamentului [32] .
Cardioprotecție medicală
Experiența acumulată de-a lungul anilor cu chimioterapie demonstrează că depistarea timpurie și tratamentul leziunilor cardiovasculare pot reduce semnificativ manifestările clinice ale daunelor și pot îmbunătăți prognosticul pacienților.
În prezent, există date despre rolul inhibitorilor ECA în prevenirea și tratamentul cardiotoxicității [33]. Se știe că reduc încărcătura, stresul ventricular stâng, îmbunătățesc debitul cardiac, protejează miocitele de proprietățile de creștere ale angiotensinei II, reduc fibroza miocardică și reduc apoptoza. De asemenea, se crede că inhibitorii ECA au un efect antioxidant și inactivează radicalii liberi.
Un studiu realizat de Cardinale și colab. A demonstrat că tratamentul precoce cu enalapril la pacienții cu leziuni miocardice dovedite după chimioterapie a împiedicat dezvoltarea cardiotoxicității [33]. Datele din diferite modele experimentale sugerează o influență puternică a sistemului renină-angiotensină-aldosteron în dezvoltarea cardiotoxicității induse de antraciclină [34]. Există, de asemenea, dovezi care susțin rolul beta-blocantelor și al blocantelor ARB în prevenirea cardiotoxicității [35]. .
În concluzie, am putea împărtăși opinia că studiul funcției cardiovasculare este un punct important în tratamentul pacienților cu cancer, care vizează depistarea precoce și prevenirea complicațiilor.
- Connell McNeills este vindecat de cancer fără chimioterapie
- Smoothie sănătos pentru mai multă energie; ce să ai grijă de Tialoto
- Primarul a lovit un jeep cu un copil
- Ce mănuși de lucru să alegi
- Sănătos slab cu săruri Schussler - Boli - Sănătate