Dr. Ivayla Uzunova
Centrul Clinic de Endocrinologie, Universitatea de Medicină - Sofia
rezumat
Deficitul de hormon de creștere la adulți se caracterizează prin deteriorarea stării generale, scăderea capacității fizice, modificări ale distribuției țesutului adipos cu obezitate centrală, hiperlipidemie, tendință la aterogeneză și scăderea remodelării osoase. Diagnosticul este în primul rând de laborator și se face pe baza nivelurilor serice scăzute ale factorului de creștere asemănător insulinei 1 și a răspunsului anormal al hormonului de creștere în timpul testelor de stimulare. Tratamentul de substituție are un profil de siguranță bun și efecte secundare relativ puține, cu condiția să fie titrat individual la fiecare pacient și să se administreze cele mai mici doze eficiente.
Existența „hormonului de creștere” și presupusa sa acțiune de accelerare a creșterii a fost menționată pentru prima dată de Cushing în 1912. Câteva decenii mai târziu, Li, Papkoff și Raben au reușit să izoleze hormonul de creștere (GH) de glanda pituitară umană, care în 60- În în acei ani a început să fie folosit ca agent terapeutic la copiii cu statură mică. Aspectele pediatrice ale problemei, precum și suprasecreția în acromegalie, au atras atenția cercetătorilor și clinicienilor în următorii peste 20 de ani, cu niveluri scăzute de HR considerate a avea o semnificație fiziopatologică redusă după creștere. Cu toate acestea, odată cu începerea producției de HR recombinantă în anii 1980, au început studii aprofundate asupra efectelor sale dincolo de semnificația sa pentru atingerea creșterii finale. Se stabilește influența sa asupra metabolismului, structurii corpului și stării fizice generale.
Etiologie și frecvență
Deficitul de hormon de creștere la adulți (DRHV) apare ca urmare a secreției reduse de somatotropină din glanda pituitară anterioară și este împărțit în două grupuri majore:
(a) Hiposomatotropismul persistând din copilărie.
(b) RDC dobândit după finalizarea creșterii.
Cei mai comuni factori etiologici, conform celei mai recente opinii de specialitate a Societății Endocrinologice Americane, sunt prezentați pe scurt în tabel. 1 [1]. În copilărie, hiposomatotropismul se datorează în principal defectelor genetice ale axei somatotrope, precum și anomaliilor structurale din regiunea hipotalamo-hipofizară (hipoplazia glandei pituitare, agenezia infundibulului, neurohipofiza ectopică etc.). Ele pot provoca atât DRH izolat, cât și deficiențe tropicale multiple. Cauzele DRC dobândite sunt similare cu cele care afectează alți hormoni hipofizari - tumori din regiunea hipotalamo-hipofizară (cel mai adesea adenoame sau craniofaringioame) și chirurgicale sau radioterapice ale acestora. Infecțiile sistemului nervos central, bolile infiltrative și granulomatoase, sindromul Sheehan și leziunile cerebrale traumatice sunt mai puțin frecvente. Existența unui DRH idiopatic izolat emergent de novo este refuzată în prezent la adulți.
Masa. 1. Etiologia sindroamelor DRHV
A. NĂSCUT
1. Genetic (defecte ale factorilor de transcripție (PIT-1, PROP-1), defecte ale receptorilor hormonali care eliberează RH, defecte ale genei RX, defecte ale receptorului RX și defecte postreceptoare)
2. Asociat cu defecte structurale ale creierului (displazie septo-optică, sindrom gol sella turcica, chist arahnoidian)
3. Asociat cu defecte ale liniei medii
B. OBȚINEȚI
1. Traumatic (perinatal și postnatal)
2. Infecții ale SNC
3. Tumori în regiunea hipotalamo-hipofizară (adenom hipofizar, craniofaringiom, chist de buzunar al lui Rathke, gliom, astrocitom, germinom, tumori metastatice)
4. Boli infiltrative și granulomatoase (histiocitoză, sarcoidoză, tuberculoză, hipofiză)
5. Radioterapia în zona craniană
6. Intervenții neurochirurgicale în regiunea hipotalamo-hipofizară
7. Atacuri de cord (spontan, sindromul Sheehan)
8. Idiopatic
FIG. 1. Frecvența elementelor sindromului metabolic la pacienții bulgari cu DRHV comparativ cu grupul de control
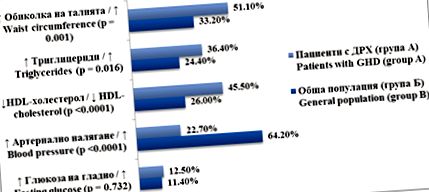
Efectele adverse descrise asupra profilului lipoproteinelor, structurii corpului și sensibilității la insulină prezic o tendință crescută la aterogeneză timpurie, ceea ce este confirmat de datele ultrasonografice pentru a crește grosimea mediului intima a vaselor coronare și a formării plăcii în arterele mari. O deteriorare suplimentară a funcției cardiovasculare are loc datorită scăderii masei și grosimii ventriculului stâng, a dimensiunii telediastolice și a volumului accident vascular cerebral al inimii. Au fost observate, de asemenea, creșteri ale markerilor disfuncției endoteliale (homocisteină, proteină C reactivă, fibrinogen, inhibitor activator plasminogen tip 1). Toți acești factori de risc au ca rezultat creșterea morbidității și mortalității prin boli cardiovasculare și cerebrovasculare, în special la femei și la pacienții cu hiposomatotropism post-creștere [8,9,10,11,12] .
DRHV este, de asemenea, asociat cu scăderea densității minerale osoase (BMD) și creșterea riscului de fractură [13,14]. Măsurătorile formării osoase și parametrii resorbției osoase corespund unei stări de remodelare osoasă redusă atât pentru tipurile de os cortical, cât și pentru cele trabeculare.
Este important să rețineți că, cu excepția nanismului hipofizar al copilăriei, precum și a unor rare defecte genetice care afectează axa somatotropă în mod izolat, hiposomatotropismul la adulți este de fapt întotdeauna însoțit de o deficiență a altor hormoni hipofizari. Prin urmare, semnele clinice ale DRHV se suprapun cu cele ale altor deficiențe tropicale.
Diagnostic
Având în vedere imaginea clinică nespecifică, diagnosticul de DRHV este în principal de laborator și necesită o serie de teste hormonale, efectuând adesea teste de stimulare într-un cadru internat. Costul relativ ridicat al procesului de diagnosticare, precum și necesitatea spitalizării în instituții medicale specializate, determină necesitatea unei selecții adecvate a pacienților care urmează să fie examinați. Pacienții cu antecedente de: boli hipofizare, radioterapie sau intervenție neurochirurgicală în regiunea craniană, leziuni cerebrale traumatice și hiposomatotropism care au apărut în copilărie sunt suspectați.
Principalul factor care complică diagnosticul este natura pulsatilă a secreției de HR, care în perioadele de vârf cade adesea sub pragul de sensibilitate al radioimunotestului convențional. Aceasta determină incapacitatea stării axei somatotrope de a fi evaluată printr-o singură măsurare a nivelurilor serice ale pH-ului. Valoarea scăzută găsită accidental nu dovedește prezența DRH.
Cea mai fiabilă metodă de diagnostic este determinarea concentrațiilor serice de RH în timpul testelor de stimulare. În prezent, „standardul de aur” este testul de hipoglicemie a insulinei. Se efectuează prin administrarea intravenoasă de insulină umană cu acțiune rapidă la o doză obișnuită de 0,1-0,15 U/kg. PX și nivelurile de glucoză plasmatică au fost monitorizate de mai multe ori până la 120 de minute după injectarea insulinei. Pentru ca testul să poată fi interpretat, nivelul de glucoză trebuie să scadă sub 2,2 mmol/l (hipoglicemia este unul dintre cei mai puternici stimuli pentru secreția de PH). Răspunsul normal la RX este creșterea acestuia sub 5 μg/l în timpul testului. Testul se efectuează numai într-un cadru intern sub supravegherea constantă a personalului medical calificat. Este extrem de important să asigurați un acces vascular fiabil înainte de începerea testului, precum și să fiți gata pentru administrarea imediată a glucozei parenterale, dacă este necesar. Este contraindicat la pacienții cu antecedente de boli cardiovasculare și cerebrovasculare, epilepsie, vârsta> 55-60 de ani.
Contraindicațiile menționate mai sus impun introducerea de noi teste de stimulare, printre care, ca cea mai bună alternativă, a fost necesar testul combinat cu hormonul care eliberează RH (PX-PX) și arginina. PX-PX este cel mai puternic stimulator al secreției de somatotropină. Utilizarea acestuia are semnificativ mai puține efecte secundare, dintre care cele mai frecvente sunt spălarea tranzitorie și parestezii. Testul are o valoare diagnostică foarte mare și este utilizat în mod obișnuit în practica clinică în mai multe țări europene, chiar și ca prim instrument de diagnostic. Principala limitare a aplicării sale este costul ridicat al RH-RH.
O altă opțiune de diagnostic este testul glucagonului, care a fost confirmat în opinii de consens ca cea mai echivalentă alternativă la hipoglicemia insulinică în condiții de incapacitate de a efectua testul cu PX-PX și arginină. Se realizează prin administrare subcutanată sau intramusculară de glucagon. Nivelurile PX sunt monitorizate timp de 3-4 ore datorită stimulării PX mai lente, care este cel mai probabil datorită stimulării secundare a insulinei endogene. Cele mai frecvente efecte secundare sunt greața și vărsăturile. Nu trebuie neglijată posibilitatea unor evenimente hipoglicemice întârziate.
În prezent, în Bulgaria, diagnosticul de DRVV se efectuează în mod curent la Centrul Clinic de Endocrinologie utilizând teste cu hipoglicemie de insulină și glucagon.
Pentru diagnostic este necesară o examinare combinată a IRF-1 și RH (de obicei în cursul unui test de stimulare). Cel mai adesea, pacienții cu DRH au niveluri scăzute de IRF-1 și RH și un răspuns anormal la testele funcționale. Conform ultimelor orientări ale Societății Endocrinologice Americane din 2011 [1], în prezența a trei sau mai multe alte deficite hipofizare, probabilitatea de DRH este aproape de 100%, prin urmare, stabilirea unei valori scăzute a IRF-1 adecvată vârstei este suficient pentru a pune diagnosticul. În toate celelalte cazuri (în prezența a mai puțin de trei deficite tropicale sau în înregistrarea nivelurilor normale de IRF-1) este necesar să se efectueze un test de stimulare. O condiție necesară înainte de începerea procedurilor de diagnostic pentru evaluarea rezervelor axei somatotrope este înlocuirea adecvată a deficitelor pituitare rămase.
În ciuda consensului stabilit, diagnosticul de RDC este încă o provocare în unele grupe de vârstă. Aceștia sunt pacienți vârstnici, la care nivelurile de IRF-1 nu sunt suficient de discriminatorii, având în vedere valorile lor în mod normal mai scăzute în deceniile de vârstă superioară, iar efectuarea testelor de stimulare este riscantă. Un contingent special sunt pacienții cu DRC în vârsta „de tranziție” între pubertatea târzie și vârsta adultă. Acestea necesită întreruperea terapiei de substituție și reevaluarea stării somatotrope cu teste funcționale adecvate după finalizarea creșterii, deoarece recuperarea funcției somatotrofice nu este neobișnuită (în special în DRH idiopatic izolat). Excepție fac pacienții cu panhipopituitarism dovedit, defecte genetice, structurale sau de altă natură în dezvoltarea regiunii hipotalamo-hipofizare, care provoacă DRH sever și ireversibil. Cu toate acestea, există încă întrebări cu privire la pragurile pentru HR în timpul testelor dinamice la această vârstă.
Tratament
De mai bine de 35 de ani, RH a fost utilizat doar pentru a influența creșterea la copiii cu DRC. Rezultatele primelor încercări de terapie de substituție la pacienții adulți au fost publicate abia în 1989. Datele disponibile în prezent [15,16,17,18,19] arată că substituirea cu PX are un efect semnificativ asupra metabolismului proteinelor, lipidelor și energiei, deoarece provoacă o creștere a țesutului adipos și o scădere a grăsimii corporale, în special a țesutului adipos visceral. Există o scădere a nivelului de colesterol total și LDL, precum și un efect mai slab asupra trigliceridelor. Îmbunătățește calitatea vieții, forța musculară și capacitatea fizică generală, funcția inimii și funcția diastolică; reduc grosimea mediului intima, precum și nivelurile unor factori proinflamatori implicați în patogeneza bolilor cardiovasculare. Se activează atât formarea osoasă, cât și resorbția, ceea ce duce la o creștere a DMO.
PX se administrează subcutanat seara pentru a imita la maximum secreția spontană de PX, dozele de înlocuire fiind semnificativ mai mici decât la copii. Se recomandă dozele inițiale de 0,2 mg la bărbați și 0,3 mg la femei, urmate de titrare la fiecare 1 lună în funcție de valorile IRF-1. Scopul este menținerea nivelurilor normale de IRF-1 pentru vârsta și sexul respectiv. La femei, sunt deseori necesare doze mai mari pentru a menține nivelurile de IGF-1, în special în cazul administrării concomitente de estrogen oral.
PX este produs în prezent prin tehnologia ADN-ului recombinant. Trei medicamente au fost înregistrate în Bulgaria: Genotropin (Pfizer), Norditropin Simplex (Novo Nordisk) și Omnitrop (Sandoz), care sunt în prezent rambursate integral de NHIF numai pentru pacienții cu vârsta peste 18 ani cu RDC persistentă din copilărie.
Contraindicațiile terapiei de substituție sunt: prezența unei boli maligne active, hipersensibilitate la activ sau excipienți, sarcină și alăptare.
În prezent, efectele benefice ale RH, în raport cu majoritatea parametrilor cardiovasculari, au fost dovedite. Cu toate acestea, întrebarea dacă efectul acestor markeri surogat duce la o reducere reală a riscului de boli cardiovasculare și mortalitate pe termen lung rămâne controversată. Subiectul duratei optime a terapiei de substituție, precum și adecvarea tratamentului pacienților vârstnici (> 60-70 de ani) este, de asemenea, larg discutabil. Cu toate acestea, majoritatea cercetătorilor sunt unanimi cu privire la beneficiile terapiei de substituție la pacienții mai tineri, în special la cei cu RDC din copilărie. La acestea, tratamentul trebuie continuat după părăsirea vârstei pediatrice, având în vedere beneficiile sale incontestabile în ceea ce privește structura corpului și mai ales pentru a atinge masa osoasă de vârf, care apare la ani după atingerea creșterii finale.
În prezent, tratamentul cu RH la adulți este indicat numai la pacienții cu hipopituitarism. Posibilitatea utilizării RH într-o serie de alte boli a făcut, de asemenea, obiectul cercetărilor din ultimii ani: condiții catabolice (arsuri extinse, malnutriție severă), condiții critice, osteoporoză, cașexie asociată cu HIV (aprobată în SUA de către Food and Administrarea medicamentelor). Până în prezent, utilizarea sa pentru terapia anti-îmbătrânire nu este permisă.
În Bulgaria, DRHV este încă o patologie relativ puțin cunoscută și rareori căutată. De câțiva ani, diagnosticul și tratamentul acestuia au făcut parte din practica de rutină a Centrului Clinic de Endocrinologie, cu accent pe terapia de substituție continuă la pacienții cu hiposomatotropism persistent după copilărie - o problemă pentru care există o cooperare activă cu unitățile pediatrice de conducere din tara.
- Dieta pentru urticarie la copii și adulți - Revista pentru femei
- Dieta și nutriția în formarea pietrelor oxalate în meniul pentru rinichi pentru copii și adulți
- Dieta pentru pielonefrita în recomandările și recomandările dietetice pentru adulți
- Icter la adulți - ce o provoacă
- Dieta cu hormon de creștere
