Dr. Stefka Evtimova
Practică individuală, Plovdiv
Dermatita atopică (AD), cunoscută și sub numele de eczemă atopică, este adesea o boală inflamatorie cronică sau recurentă a pielii cu impact social și economic semnificativ. Afectează 2,1-4,9% din populația adultă și 15-20% din copii. În ultimele decenii, frecvența sa a crescut de 2-3 ori în țările industrializate, dar frecvența sa crește și în țările cu venituri mici.
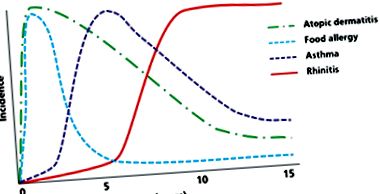
Cel mai adesea, boala începe în copilăria timpurie, ca primul pas în „marșul atopic”, care descrie evoluția naturală a manifestărilor atopice în viață. Acest model sugerează o etiologie comună pentru diferite boli atopice.
Una dintre dovezile acestei etiologii comune este mutația stabilită în gena pentru sinteza filagrinei [1] .
Studiile genetice actuale schimbă conceptul funcției de barieră a pielii. Filagrin este o proteină structurală sintetizată în stratul cornos care joacă un rol esențial în menținerea integrității barierei cutanate.
Funcția de barieră a pielii este asociată cu pierderea crescută de apă transdermică, care se exprimă în pielea uscată la acești pacienți, precum și cu penetrarea crescută a antigenelor din mediu. Gena de sinteză a filagrinei este localizată pe cromozomul uman 1q 21. Peste 30 de gene sunt implicate în diferențierea finală a epidermei. O mutație genetică pentru sinteza filagrinei apare doar la jumătate dintre pacienții cu AD.
Aceștia sunt de obicei pacienți cu debut precoce al bolii, frecvență ridicată de sensibilizare și astm bronșic concomitent (la pacienții cu astm bronșic sever, dar fără AD, o astfel de mutație nu este detectată).
Studii recente sugerează că eczema activă are ca rezultat o reducere a concentrațiilor de filagrin chiar și la pacienții cu o genă normală pentru sinteza acesteia. Astfel, disfuncția barierei cutanate este cauzată de două mecanisme - o anomalie structurală congenitală și modificări inflamatorii secundare în proteina filagrin. Acest lucru subliniază importanța ambelor concepte pentru mecanismul JSC „în afară” și „în afară” (Fig. 1).
Figura 1: Marș atopic
AD continuă cu pielea uscată, mâncărime intensă și modificări eczematoase care fluctuează în timp. Factorii de risc care determină durata dermatitei atopice mai târziu în viață sunt debutul precoce, rinita alergică, eczema mâinilor.
Etiologia AD este încă o chestiune de cercetare și interpretare. Percepută inițial ca o boală pur alergică, AD a fost recent interpretată în contextul interacțiunii complexe dintre predispoziția genetică la o barieră epidermică disfuncțională și/sau compoziția lipidică, pe de o parte, și expunerea la factori nocivi de mediu. Mai mult, alergia este probabil un epifenomen din cauza funcției afectate a barierei cutanate la persoanele atopice. Sensibilizarea alergenică este legată de exacerbările bolii și de formele persistente.
Următoarele boli alergice apar la copiii cu AD:
- Aproximativ 1/2 din copiii cu AD (în special formele severe) au alergii alimentare.
- 2/3 din copiii cu AD dezvoltă rinită alergică.
- 1/3 din copiii cu AD dezvoltă astm bronșic.
Alergia alimentară în AD este observată în primul an de viață, cea mai frecventă fiind alergia la proteinele din laptele de vacă, urmată de cea la albușul și gălbenușul. Opt alimente reprezintă aproximativ 90% din alergiile alimentare la copii: lapte, ouă, grâu, soia, pește, fructe de mare, arahide, nuci (Fig. 2).
Figura 2: Opt alimente provoacă 90% din alergiile alimentare
Suspiciunea și dovada alergiei alimentare în formele severe de AD sunt obligatorii.
Eliminarea alimentelor alergenice din dietă duce la o îmbunătățire semnificativă a stării pielii. Diagnosticarea alergiei alimentare în copilăria timpurie nu este întotdeauna o sarcină ușoară, deoarece mecanismele patogenetice care o determină sunt diferite. În general se folosește următorul algoritm de diagnostic:
1. Testele de alergie cutanată:
- Prick test
- Testul patch-urilor
- Testul intepatura cu intepatura
2. Demonstrarea anticorpilor IgE specifici în sânge.
3. Dieta provocatoare pentru eliminare.
4. Provocarea alimentelor dublu-orb, controlată cu placebo - standard de aur; numai în medii clinice.
În 2018, în două studii de cohortă efectuate independent (urmate de la 0 la 16 ani), respectiv în Marea Britanie (ALSPAC) la 9.894 copii și Olanda (PIAMA) la 3.652 copii, pentru prima dată au fost identificate cinci subfenotipuri de dermatită atopică în copilărie [3]. Coincidența în rezultatele celor două studii este impresionantă (Fig. 3).
Lavinia Paternoster, dr., A, * Olga E.M. Dr. Savenije; Clasele longitudinale identificate folosind LLCA în 2 cohorte independente de naștere: A, ALSPAC (n = 9894) și B, PIAMA (n = 3652).
1. AD, începând la sugari și continuând mai târziu în viață.
2. AD, începând la sugari și continuând în timpul copilăriei.
3. AD, începând la sugari și terminând în copilăria timpurie la 6-7 ani
4. AD, începând cu aproximativ 6 ani. vârstă și durează până la sfârșitul copilăriei.
5. AD, începând cu copilăria târzie (vârsta de 11 ani) și terminând mai târziu în viață.
Majoritatea copiilor au fost în grupul 3 - cu debut precoce și se termină în copilăria timpurie. Acest subtip este asociat cu sexul masculin. Ambele subtipuri cu persistență a bolii (debut precoce, persistent; și debut precoce, care se termină mai târziu în viață) sunt asociate cu mutații genetice în sinteza filagrinei, precum și cu istoricul personal și familial al bolilor atopice.
Aproximativ 1/3 din copiii cu AD au manifestări la scurt timp după naștere și „dezvoltă” boala în jurul vârstei de 5 ani.
Acești copii, la care persistă eczema, au mai multe șanse de a avea antecedente familiale ale bolii, precum și un risc de boli alergice ulterioare, cum ar fi rinita alergică și astmul bronșic.
Factorul de risc genetic presupune un curs de AD mai sever și pe termen lung (uneori pe viață) și la acești pacienți vor fi efectuate studii suplimentare pentru a căuta o abordare și un tratament personalizat.
Noi terapii biologice în tratamentul AD
Formele refractare severe de AD care nu răspund la tratamentul cu terapia convențională pot fi îmbunătățite prin noi terapii biologice. Progresul în înțelegerea imunopatologiei AD permite identificarea și aplicarea de noi molecule țintă în domeniul terapiei biologice [9] .
Imunoterapie alergenică. În formele severe de AD, sensibilizarea se găsește nu numai la alimente, ci și la adăpostirea acarienilor (Fig. 4).
Imunoterapia alergenică în ambele forme (subcutanată și sublinguală) este un tratament eficient pentru rinoconjunctivita alergică. Beneficiile copiilor cu dermatită atopică și alergie dovedită la acarieni au fost mult timp discutate.
Rezultatele studiilor clinice sunt contradictorii. Imunoterapia cu acarieni a fost efectuată la 56 de copii cu AD severă (Fig. 5), cu îmbunătățirea semnificativă a stării pielii în comparație cu grupul de control. În alte studii, un astfel de rezultat nu a fost raportat. Sunt necesare cercetări viitoare pentru identificarea acestor subgrupuri de copii cu AD severă, precum și a noilor biomarkeri care prezic un răspuns bun la imunoterapie.
Omalizumab este un anticorp IgG1 monoclonal recombinant, umanizat. Rezultatele aplicării sale pentru tratamentul formelor severe, refractare de AD sunt contradictorii. Deși majoritatea datelor din studiile randomizate mici au arătat o îmbunătățire clinică a eczemelor, un număr mic de studii nu au arătat nicio îmbunătățire a terapiei cu Omalizumab. Răspunsul la terapie depinde de absența unei mutații a genei de sinteză a filagrinei și de nivelul inferior al IgE serice totale. Aceștia sunt factorii asociați cu un răspuns mai bun la terapia anti-IgE. Toate studiile au arătat un profil de siguranță bun atât la adulți, cât și la copii cu vârsta peste 12 ani tratați cu Omalizumab. În orice caz, prezența unei mari variabilități în răspunsul la acest tratament, precum și lipsa protocoalelor standardizate, sunt probleme care trebuie abordate. La pacienții cu AD severă, refractară, cu diateză atopică (sensibilizare la acarieni, IgE totală serică moderată, astm bronșic concomitent și rinită alergică), Omalizumab 300 mg o dată pe lună a dus la o îmbunătățire semnificativă, care a fost detectată în primele trei luni de la tratament [ 4,5] .
Dupilumab este un anticorp monoclonal complet umanizat împotriva receptorului α al interleukinei 4 (IL-4). Dupilumab, ca terapie mono sau combinată, are ca rezultat controlul eficient al bolii, îmbunătățirea leziunilor cutanate, reducerea semnificativă a pruritului și îmbunătățirea calității vieții la pacienți. În AD severă, efectul a fost observat după 4 săptămâni de tratament cu Dupilumab. Răspunsul la Dupilumab este rapid, eficient și sigur [6,8] .
AD este încă o provocare majoră atât pentru medici, cât și pentru pacienți, în special pentru formele refractare. Progresul în înțelegerea fiziopatologiei sale dezvăluie multe fețe (subtipuri), ceea ce permite o abordare personalizată și utilizarea de noi molecule biologice pentru răspunsul terapeutic (Fig. 6). În ultimii ani, pe lângă tratamentul convențional, s-au acumulat o mulțime de date despre efectul imunoterapiei specifice alergenului în cazuri selectate de AD. Există, de asemenea, date incontestabile privind eficacitatea Dupilumab, în timp ce alți agenți imunomodulatori (cum ar fi Nemolizumab, Lebrikizumab, Tralokinumab, Ustekinumab și Apremilast) prezintă un efect promițător, dar neconfirmat și siguranță în AD.
- Dermatită atopică - Îngel Face - Saloane de înfrumusețare
- 10 lucruri care disting o femeie de o fată - punctul de vedere al unui bărbat
- 50 de nuanțe mai plictisitoare decât punctul de vedere masculin - filme
- Dermatita atopica AROMA
- Dermatita atopică - ce este și cum să o îngrijești