R. Dimitrova, M. Boyadzhieva, K. Hristozov
Clinica de endocrinologie și boli metabolice, Spitalul Universitar „St. Marina ”, Universitatea de Medicină, Varna
Pacienții cu diabet zaharat de tip 2 (T2HD) prezintă un risc crescut de fracturi osoase [1], iar principalul motiv pentru aceasta este considerat a fi calitatea osoasă redusă [6] .
Mai multe mecanisme pot explica deteriorarea calității osoase la persoanele cu diabet zaharat. De exemplu, acumularea produselor finale avansate de glicație (AGE) în matricea osoasă organică are ca rezultat formarea unui os fragil biomecanic [6]. .
În plus, glucozuria cu control glicemic afectat este asociată cu hipercalciuria, care crește riscul de demineralizare osoasă. Acumularea de lipide în măduva osoasă la un raport crescut în favoarea lipidelor saturate predispune și la scăderea formării osoase [6]. Se observă dilatația canalului osos al oaselor lungi și subțierea țesutului cortical.
Microangiopatia diabetică este, de asemenea, cauza tulburărilor microstructurale la nivelul osului, ducând la creșterea porozității corticale și a deficitului biomecanic, precum și la un risc ridicat de fracturi - cu 46% mai multe fracturi de șold și cu 27% mai multe fracturi ale coloanei vertebrale (conform studiului WHI). Riscul de fracturi de șold este deosebit de ridicat în cazurile de nefropatie diabetică. Niveluri crescute de sclerostină serică (un produs al osteocitelor) au fost, de asemenea, observate în T2HD, posibil datorită afectării sensibilității mecanice, ducând la inhibarea situsului de integrare legat de Wntless - β-catenină [6] .
Hipoglicemia, tulburările vizuale și neuropatia diabetică sunt condiții prealabile pentru instabilitate și un risc crescut de căderi care duc la fracturi [6]. .
În plus, unele medicamente antidiabetice pot afecta în mod direct metabolismul osos și pot crește riscul de fracturi [4]. .
Tiazolidinedionele, de exemplu, activează PPAR-gamma (receptorul activat al proliferatorului peroxizomului gamma). Acest lucru stimulează diferențierea celulelor stem mezenchimale (MSC) în adipocite, ducând la o scădere a osteogenezei. O incidență mai mare a fracturilor osoase și a scăderii densității minerale osoase (BMD) a fost, de asemenea, observată cu canagliflozin, primul inhibitor de tip 2 co-transportor al glucozei de sodiu (SGLT2i) care a apărut pe piață [17]. Cu toate acestea, nu se știe încă dacă SGLT2i rămas (dapagliflozin și empagliflozin) prezintă aceleași riscuri.
Alte medicamente antidiabetice cunoscute au fost asociate cu efecte benefice asupra osteogenezei prin acțiune directă asupra CSM și osteoblaste. De exemplu, utilizarea metforminei la animalele experimentale cu diabet indus a arătat efecte benefice ale medicamentului asupra diferențierii și funcției osteoblastelor, niveluri crescute de fosfatază alcalină, sinteza de colagen de tip I și acumulare crescută de calciu osos [20]. .
Obezitatea abdominală, care este frecvent observată în T2D, predispune, pe de o parte, la o DMO mai mare, datorită efectului protector al țesutului adipos. Promovează formarea osoasă prin stres mecanic ridicat, niveluri ridicate de insulină circulantă și alți factori care sunt secretați odată cu aceasta [5]. Pe de altă parte, rezistența la insulină, care este asociată cu obezitatea viscerală, predispune la inflamație cronică de grad scăzut, care are un efect negativ asupra osului, contrabalansând efectul protector al țesutului adipos crescut [5]. .
În același timp, se știe că pierderea în greutate este adesea asociată cu o scădere a conținutului mineral osos și a DMO datorită unui dezechilibru între resorbția osoasă și formarea osoasă, ceea ce crește riscul de fractură [1]. Modificările mecanice cauzate de sarcina scheletică din cauza pierderii în greutate, precum și modificările hormonale care apar, sunt explicații probabile [1]. Aportul insuficient de calciu și vitamina D în timpul restricționării caloriilor poate promova și mai mult resorbția osoasă [1] .
Dezvoltarea de noi modalități de a trata diabetul și obezitatea este foarte importantă, având în vedere creșterea continuă a prevalenței acestora. Deoarece pierderea în greutate este adesea asociată cu pierderea osoasă, resp. riscul crescut de fractură, este de o mare importanță clinică să luați în considerare acest lucru atunci când inițiați terapia cu medicamente pentru slăbit.
Promițători în acest sens sunt agoniștii receptorilor (RA) ai peptidei-1 asemănătoare glucagonului (GLP-1). Ele nu numai că ajută la reducerea greutății. Datorită profilului lor de acțiune glucoreglator, GLP-1 RA reduce și riscul altor comorbidități legate de obezitate [1]. Tratamentul cu ei este, de asemenea, puțin probabil să provoace hipoglicemie, care poate fi o condiție prealabilă pentru prevenirea fracturilor traumatice. Un studiu realizat de Wen și colab. sugerează că liraglutida are potențialul de a proteja sănătatea oaselor la populația diabetică postmenopauză, dar această idee ar trebui clarificată în viitoarele studii clinice [4]. .
Mecanisme potențiale de acțiune a GLP-1 asupra metabolismului osos
Multe studii științifice s-au concentrat asupra mecanismelor de acțiune ale medicamentelor bazate pe hormoni stimulatori ai insulinei, precum GLP-1. Rezultatele arată că un astfel de tratament crește DMO și îmbunătățește calitatea oaselor [2]. Un studiu pe termen lung al liraglutidei la femeile obeze care au obținut pierderea în greutate a demonstrat un efect anabolic al medicamentului asupra oaselor, cu o creștere a nivelului colagenului de tip 1 al markerului N-terminal propeptid terminal (NTP1) [1]. .
Datele din literatura de specialitate privind asocierea dintre GLP-1 RA și fracturile osoase sunt încă contradictorii, deși o meta-analiză a evenimentelor de fractură la pacienții cu diabet a arătat că acestea scad odată cu tratamentul cu Liraglutidă [16]. S-a demonstrat că GLP-1 acționează asupra țesutului osos prin promovarea formării osoase și inhibarea resorbției osoase. 1 de Zhao C. și colab. [2] .
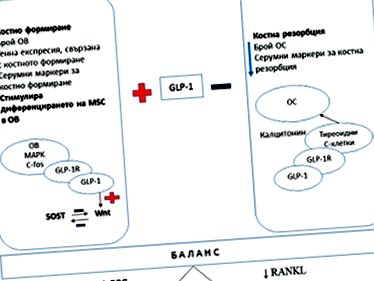
Figura 1:
Ligand activator al receptorului RANKL pentru expresia factorului nuclear kB;
OPG - osteoprotegerină;
VO - osteoblast;
OS - osteoclast;
MAPK - proteina kinază activată cu mitogen;
C-fos - factor de transcripție, protooncogen;
Wnt (site-ul de integrare legat de Wingless) - principala cale de semnalizare în osteoblastogeneză;
SOST - gena sclerostinei.
Formarea oaselor și GLP-1
Observațiile sugerează că GLP-1 poate juca un rol în diferențierea osoasă osteogenă. S-a demonstrat că GLP-1 crește numărul de osteoblaste și sprijină expresia genelor, cum ar fi Runx2 (factor de transcripție), care determină expresia genelor specifice osteoblastelor asociate cu formarea osoasă. S-a sugerat că GLP-1 poate ajuta, de asemenea, la transcrierea proto-oncogenului c-Fos în osteoblaste și, astfel, potențează metabolismul osos [10]. În plus, există o creștere a nivelului markerilor serici asociați cu formarea osoasă (fosfatază alcalină, osteocalcină, NTP1) [2]. Mecanismele prin care este mediat acest efect pozitiv sunt prin intermediul receptorilor GLP-1, exprimați în principal pe celulele stromale ale măduvei osoase. Astfel, GLP-1 RA promovează diferențierea osteoblastelor și inhibă diferențierea celulelor stem în adipocite. S-a demonstrat că receptorii GLP-1 modifică expresia în diferite etape ale liniilor celulare de osteoblasti. Nivelul expresiei receptorului GLP-1 la osteoblaste scade odată cu procesul de maturare, dar expresia crescută este observată în timpul procesului de diferențiere a celulelor stem osteogene [18,19] .
GLP-1 este considerat a fi un activator direct al căii Wnt, o cale de semnalizare majoră care stimulează diferențierea și maturarea osteoblastelor [7]. .
În plus, activarea receptorului GLP-1 a fost observată pentru a reduce nivelul sclerostinei, care inhibă formarea osoasă, prin suprimarea căii de semnalizare Wnt [8]. Proliferarea și diferențierea osteoblastelor, ajutată de GLP-1, este cel puțin parțial mediată de protein kinaza activată cu mitogen [9] .
Se știe că hiperglicemia este asociată negativ cu DMO la nivelul coloanei lombare. Prin controlul nivelului de glucoză prin stimularea secreției de insulină, inhibarea secreției de glucagon și întârzierea golirii gastrice, GLP-1 contribuie în continuare la creșterea formării osoase [2]. .
Resorbția osoasă și GLP-1
S-a demonstrat că GLP-1 afectează numărul și funcția osteoclastelor [2]. S-a raportat că șoarecii cu deficit de receptor GLP-1 dezvoltă osteopenie cu un număr crescut de osteoclaste și o resorbție crescută a oaselor [15]. Acest lucru dovedește efectul inhibitor al GLP-1 în osteoclastogeneză [15]. Cu toate acestea, speculațiile despre efectul inhibitor al GLP-1 asupra resorbției osoase continuă [2]. Niveluri scăzute de markeri serici asociați cu resorbția osoasă (telopeptidă C-terminală de tip 1 colagen - CTX-1, raport urinar de deoxipiridinolină/creatinină) au fost observate la șobolani cu osteoporoză după ovarectomie tratată cu [Exendin-4]. Cu toate acestea, 52 de săptămâni de tratament la femeile obeze sănătoase cu liraglutidă nu au prezentat un efect semnificativ asupra nivelului seric al CTX-1 [1]. Se consideră că GLP-1 poate inhiba resorbția osoasă prin calea dependentă de calcitonină, dar această ipoteză necesită în continuare clarificări suplimentare [2]. .
Influența GLP-1 asupra echilibrului dintre formarea osoasă și resorbția osoasă
S-a demonstrat că liraglutida influențează diferențierea MSC în osteoblaste, mai degrabă decât în adipocite [3]. Studiul suplimentar al mecanismelor moleculare ale acestui efect a arătat că GLP-1 a crescut proliferarea MSC, a inhibat procesul de adipogeneză timpurie și a redus moartea celulară. Alte două studii relevă noi mecanisme moleculare ale Exendin-4. Primul arată că Exendin-4 reduce stresul asupra reticulului endoplasmatic, care inhibă apoptoza MSC ale măduvei osoase [13]. Un al doilea studiu arată că Exendin-4 poate regla creșterea, mobilizarea și supraviețuirea MSC [14] .
Rezultatele unui număr de studii sugerează că activarea căii de semnalizare liraglutidă și GLP-1 poate suprima osteoclastogeneza prin modularea raportului RANKL/OPG (ligand activator receptor pentru expresia factorului nuclear kV/osteoprotegerină) [4] .
Un studiu realizat de Ma et al. la șobolanii adulți ovarectomizați au relevat că GLP-1 poate avea o dublă funcție anti-osteoporotică asupra țesutului osos [11]. De exemplu, după 16 săptămâni de administrare Exendin-4, s-a observat o creștere a mARN-ului OPG, în timp ce mARN-ul RANKL a scăzut [11]. Un alt studiu a constatat că GLP-1 a avut un efect mai mare asupra nivelurilor de ARNm pentru OPG decât cele ale RANKL [12]. .
Prin urmare, GLP-1 nu numai că stimulează formarea osoasă, ci inhibă și resorbția osoasă.
În concluzie, homeostazia formării și resorbției osoase este esențială pentru sănătatea oaselor. Se pare că GLP-1 îl poate menține în oase sănătoase și îl poate restabili în oase modificate patologic [2]. Cu toate acestea, moleculele și mecanismele specifice responsabile pentru aceasta nu sunt încă pe deplin înțelese [2]. .
- Influența alăptării asupra sănătății copilului
- Influența antidepresivelor asupra dezvoltării creierului fetal în timpul sarcinii; LexMedica
- Influența muzicii clasice asupra sănătății noastre - Health Resort
- Impactul apei reci asupra sănătății dvs. - Succes în Bulgaria!
- Influența factorilor biotici asupra plantelor; ry