Nefropatia IgA este definită de prezența depozitelor mezangiale difuze dominante sau codominante ale imunoglobulinei A (IgA). Aspectul histologic este foarte variabil, cu modificări mezangiale mai frecvente - proliferarea celulară și/sau a matricei. Clinic, cele mai frecvente constatări sunt hematuria microscopică (persistentă sau intermitentă) și macrohematuria episodică. Nefropatia IgA a fost descrisă pentru prima dată de Berger și Hinglais în 1968 și este, de asemenea, cunoscută sub numele de boala Berger.
Nefropatia IgA este cea mai frecventă glomerulonefrită la nivel mondial, dar boala Berge agresivă se află pe lista bolilor rare. Primar Nefropatia IgA se caracterizează prin depunerea anticorpului IgA în glomerul. Există și alte boli asociate cu depozitele glomerulare de IgA, cea mai frecventă fiind vasculita IgA (cunoscută anterior sub numele de purpură Henoch-Schönlein), considerată de mulți ca fiind o formă sistemică de nefropatie IgA. În nefropatia IgA neagresivă, progresia lentă către insuficiența renală cronică a fost observată în mod tradițional în 25-30% din cazuri pe parcursul a 20 de ani.
Majoritatea cazurilor de nefropatie IgA sunt idiopatice, dar debutul sau exacerbarea bolii este adesea precedat de o infecție respiratorie. A fost descrisă o legătură cu unele bacterii, cum ar fi Haemophilus parainfluenzae. O serie de alte boli sunt, de asemenea, asociate cu nefropatia IgA, cum ar fi ciroza și alte boli ale ficatului, enteropatia glutenului (boala celiacă), boala HIV și altele.
Nefropatia IgA este mai frecventă la asiatici și albi și este mai puțin frecventă la negri atât în Statele Unite, cât și în Africa. Condiția este adesea observată la indienii Zuni și Navajo.
Boala este mai frecventă la bărbați decât la femei. Aproape toate studiile arată o predominanță masculină de cel puțin 2: 1, cu raporturi raportate de până la 6: 1. Nefropatia IgA poate afecta toate vârstele, dar este cea mai frecventă în a doua și a treia decadă de viață. Optzeci la sută dintre pacienți au vârsta cuprinsă între 16 și 35 de ani în momentul depistării bolii. Condiția este neobișnuită la copiii cu vârsta sub 10 ani.
Boala își primește numele din acumularea de imunoglobulină A (IgA) într-un model granular în mezangiu (prin imunofluorescență), o regiune a glomerulului renal. Mesangiul poate fi hipercelular prin microscopie cu lumină și prezintă o depunere crescută de proteine pe matricea extracelulară. Din punctul de vedere al manifestării renale a purpurii Henoch-Schönlein, s-a constatat că, deși are același spectru histologic ca nefropatia IgA, se observă o incidență mai mare a leziunilor severe, cum ar fi necroza glomerulară și „semilunele”.
Nefropatia IgA pare a rezulta dintr-o secvență ordonată de evenimente, începând cu IgA1 cu deficit de galactoză, care conține mai puțin de un set complet de reziduuri de galactoză pe O-glicanii din regiunea balama a lanțului greu. Aceștia pot acționa ca autoantigeni care declanșează producerea de autoanticorpi specifici glicanului și formarea complexelor imune circulante care sunt depuse în mezangiul renal. Apoi provoacă leziuni glomerulare prin eliberarea proinflamatorie de citokine, secreția de chemokine și migrația renală rezultată a macrofagelor. Complexele imune formate din anticorpi IgG sau IgA cu IgA cu deficit de galactoză duc la depunerea în glomerul.
IgA depus este predominant IgA1 polimeric, care este produs în principal de sistemul imunitar al mucoasei. Asocierea unor cazuri de nefropatie IgA cu sindroame care afectează căile respiratorii sau tractul gastrointestinal, cum ar fi boala celiacă, sugerează că nefropatia IgA este o boală a sistemului imunitar al mucoasei. Acest concept este, de asemenea, susținut de observația clinică că hematuria se agravează în timpul sau după infecțiile tractului respirator superior sau ale tractului gastro-intestinal.
Rolul sistemului complementului în patogeneza Nefropatia IgA este controversat. În timp ce anticorpii IgA nu pot activa complementul prin calea clasică, studiile au arătat că complementul poate fi activat prin calea alternativă.
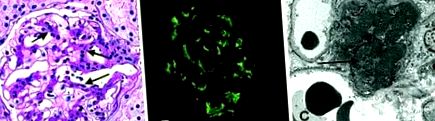
Cele mai frecvente constatări ale microscopiei cu lumină sunt proliferarea mezangială focală sau mai des difuză și mărirea matricei extracelulare (Figura 1). Morfologia poate varia de la leziuni proliferative intracapilare sau extracapilare normale la moderate sau severe. În timp ce unii pacienți au depozite de IgA pe imunofluorescență și se modifică puțin sau deloc prin microscopie cu lumină.
Uneori, pacienții au scleroză glomerulară focală, care nu diferă de glomeruloscleroza focală segmentară la microscopie cu lumină. O serie de alte constatări pot fi observate în boala avansată, inclusiv fibroza interstițială, atrofia tubulară și scleroza vasculară. Mai mulți pacienți au leziuni necrozante segmentare cu formare de semilună datorită distrugerii capilare extinse. Aceste descoperiri pot fi agenți prognostici utili la pacienții cu nefropatie IgA.
Microscopia electronică a arătat hipercelularitate mezangială și o matrice mezangială mărită. O constatare importantă este depozitele de IgA dense în electroni în mezangiu, precum cele din Figura 2, dar depozitele în regiunile subendoteliale și subepiteliale ale peretelui capilar glomerular apar la un număr mic de pacienți, în special la cei cu boală mai severă. Depozitele subendoteliale apar adesea atunci când există hipercelularitate endocapilară.
Studiile de imunofluorescență sunt semnul patologic al acestei boli. IgA se depune într-un model granular difuz în mezangiu (Figura 3) și uneori în peretele capilar. Depozitele sunt predominant IgA polimerice ale subclasei IgA1. În plus, IgG a fost detectată în 43% din cazuri și IgM în 54%. În majoritatea cazurilor, există depozite de C3 (95%) și uneori componente ale căii de activare a complementului clasic: C1q și C4 (12%). Depozitele de IgA sunt granulare mezangiale difuze la aproape toți pacienții, deși sunt uneori segmentare. Subclasa predominantă IgA este 1, iar din punct de vedere al lanțului ușor predomină lambda. Nu există o componentă secretorie a IgA. Unele studii arată că prezența acumulărilor de C4d este asociată cu o supraviețuire renală mai mică.
- Patologia esofagului lui Barrett
- Nefropatia IgA
- PHIB552 Norme și patologii sociale - Sociologie - NBU
- Hiperemia arterială Patologie
- Nefropatie metabolică demetabolică