Prof. dr. Stefan Goranov, conf. Dr. Veselina Goranova-Marinova
Secția Hematologie la Ministerul Finanțelor Plovdiv, Clinica de Hematologie Spitalul Universitar „St. Georgi ”, Plovdiv
Leucemia limfocitară cronică (LLC) reprezintă 30% din toate leucemiile și o incidență de 3-5/100.000 populație. Boala afectează în principal persoanele de vârstă mijlocie și persoanele în vârstă, cu un raport de M: F/2: 1. Cu evoluția sa lentă și prelungită, CLL este un exemplu clasic al așa-numitelor limfoame indolente non-Hodgkin, ale căror forme primare hematogene aparțin. CLL este o boală incurabilă, dar cu cea mai lungă supraviețuire de până acum, obținută prin chimioterapie convențională. Dezvăluirea biologiei creșterii neoplazice a dezvăluit mecanismele superiorității biologice absolute și a nemuririi practice a limfocitelor maligne. Mecanismele specificate natural au devenit o țintă terapeutică. Această revizuire examinează stratificarea actuală a riscului pacienților, indicațiile pentru tratamentul inițial și manipularea terapeutică prin medicamente fundamental noi - anticorpi anti-CD20, BTK, PI3K și inhibitori BCL-2. Aceștia obțin o eficacitate semnificativă și până acum necunoscută, în special la pacienții vârstnici cu risc ridicat, ceea ce a transformat regimurile chimioterapeutice utilizate anterior în istorice.
Leucemia limfocitară cronică (LLC) este o hemopatie malignă datorată proliferării clonale necontrolate și acumulării de limfocite relativ imature și cu deficit imunitar în sângele periferic, ganglionii limfatici, splina și măduva osoasă. Ele provin din zona marginală a ganglionilor limfatici, au un indice proliferativ scăzut și o supraviețuire mai lungă datorită excluderii apoptozei (moarte celulară programată) (Fig. 1 și 2). Cu evoluția sa lentă și prelungită, CLL este un exemplu clasic al așa-numitelor limfoame indolente non-Hodgkin, ale căror forme primare hematogene aparțin. CLL se numără printre cele mai frecvente boli maligne ale sângelui (30% din toate leucemiile) și o incidență de 3-5/100.000 populație. Boala afectează în principal persoanele de vârstă mijlocie și persoanele în vârstă, cu un raport de M: F/2: 1. LLC este cea mai frecventă leucemie cronică din Europa și America și o boală rară în Orientul Mijlociu și îndepărtat.
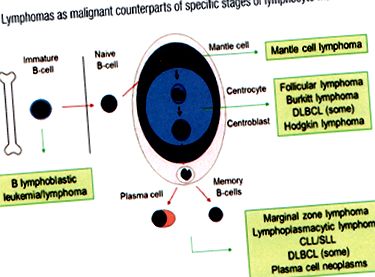
Figura 1: Originea NHL cu celule B
Figura 2: CLL - frotiu periferic
Limfocitele B normale migrează de la organele limfatice primare (măduva osoasă) la secundare (ganglioni limfatici). Când B-Ly întâlnește un antigen, se formează un centru germinal în ganglionul limfatic, unde B-Ly suferă hipermutații somatice în genele care codifică sinteza imunoglobulinei. Apoi părăsesc ganglionul limfatic ca celule plasmatice sau celule cu memorie B. Originea celulară a diferitelor malignități limfoide poate fi demonstrată de setul fenotipic de celule membranare și de rearanjarea genelor pentru lanțurile grele de imunoglobulină.
Criterii pentru diagnostic
Diagnosticul precis și precis necesită limfocitoză absolută> 5x109/l în sângele periferic, cu morfologia limfocitelor mature și fenotip caracteristic: CD5 +, CD19 +, CD20 +, CD10 +, CD23 +. Această populație clonală (malignă), care manifestă boala, poate fi precedată de o afecțiune pre-malignă numită limfocitoză monoclonală cu celule B - Stadializarea bolii și profilul de risc
Alegerea strategiei terapeutice la pacienții cu LLC este asociată cu stadializarea obligatorie și specificarea profilului de risc. În sistemele de stadiu Binet și Rai utilizate de peste 40 de ani, au fost stabiliți parametri biochimici și fizici de rutină, care și-au dovedit valoarea de prognostic independentă [1,2]. Pacienții cu LLC la diagnostic precoce au una dintre cele mai lungi mediane de supraviețuire (SM) de 10-15 ani dintre bolile limfoproliferative. Este important de reținut că o astfel de supraviețuire a fost înregistrată în epoca regimurilor convenționale de chimioterapie, fără a iniția neapărat tratament după diagnosticul bolii. Dimpotrivă, este general acceptat faptul că așa-numitul „Urmăriți și așteptați” la pacienții cu risc scăzut în stadiile incipiente ale LLC.
Stratificarea riscului
Tabelul 1: Indicele prognostic internațional pentru CLL [16]
Mutația Del 17p sau TP53
Gene IGHV nemutate
β2-microgl. > 3,5 mg/L
Etapele Rai (I-IV)
Vârsta peste 65 de ani.
Supraviețuire la 5 ani (%)
Se poate observa că 6 din 10 puncte sunt formate din cele mai riscante anomalii genetice din LLC. Există critici serioase la adresa IME, dar există o opinie unanimă conform căreia predetermină mai precis nevoia de a începe terapia la pacienții netratați, în special cu terenuri nefavorabile genetic. În criteriile pentru „începutul terapiei” din 2018, indicatorii genetici individuali nu sunt încorporați, ci sunt implicați de termenul „risc ridicat”. O condiție obligatorie pentru tratamentul inițial este specificarea stării mutației la fiecare pacient sau cel puțin TP53 (Tabelul 2).
Tabelul 2: Criterii pentru inițierea tratamentului la pacienții cu LLC (Grupul de lucru internațional privind LLC, 2018) [17]
Eșec progresiv al măduvei osoase cu HB
Splenomegalie semnificativă sau progresivă de peste 6 cm în hipocondru.
Limfadenopatie semnificativă sau progresivă> 10 cm diametru longitudinal.
Limfocitoză progresivă peste 50% pe o perioadă de 2 luni sau timp de dublare a limfocitelor
Citopenii autoimune slab afectate de GCS.
Afectare extranodală (piele, rinichi, plămâni, oase etc.).
Simptome B (transpirații nocturne, febră, mâncărime la nivelul pielii, scădere în greutate).
Pacienți într-un stadiu avansat și cu risc crescut.
Biologia dezvăluită a LLC - o țintă terapeutică modernă
Paleta terapeutică pentru tratamentul LLC în epoca modernă este extrem de diversă și rezultatul introducerii unor medicamente fundamental noi în mecanismul de acțiune. Rezultatele au fost obținute pentru eficacitate semnificativă și eficacitate pe fondul comorbidității și disfuncției organelor, în special la pacienții adulți cu risc ridicat dificil de tratat.
Anticorpi monoclonali anti-CD20. Imunochimioterapie [18-21]
CD20 este o fosfoproteină neglicozilată exprimată pe suprafața limfocitelor B pentru majoritatea bolilor limfoproliferative neoplazice. CD20 este localizat adiacent receptorului celulei B (BCR) și promovează activarea acestuia și activarea ulterioară a unui număr de căi de semnalizare importante pentru biologia celulară [19]. MCA anti-CD20 opsonizează celulele țintă și, prin citotoxicitate directă, citotoxicitate antigen-dependentă (AZKT) și mediată de complement (CMC), induc liza lor. Incorporarea MCA anti-CD20 în agenții chimioterapeutici clasici a schimbat dramatic strategia terapeutică în LLC. După primul MCA Rituximab, au apărut noi generații precum Ofatumomab (leagă epitopii mai aproape de membrană și atrage mai mult C1q, chiar și atunci când concentrația sa este scăzută în mediu) și Obinuzumab (rezultatul glicoingineriei fragmentului Fc, care leagă mult mai mult strâns) .cu FcgRIIIa, crescând astfel AZKT). Studiul CLL8 (FC + R vs FC) a arătat, de asemenea, o eficacitate și eficacitate necunoscute: răspuns terapeutic total (ORR) - 90%, răspuns complet (CR) - 40%, PFS - 52 luni. și fără efecte secundare grave. Conform studiului pe termen lung MDACC faza 2, FCR după o urmărire de aproximativ 13 ani, riscul apariției neoplasmelor mieloide secundare este de 5%, iar transformarea în sindrom Richter - 8%.
Un studiu retrospectiv realizat de MD Anderson a dovedit alte beneficii: pacienții cu boală reziduală minimă (MRD) după 3 cicluri ale schemei FCR au avut rezultate similare pe termen lung cu cei care au primit 6 cicluri, evitând toxicitatea cumulativă. În studiul CLL11 (Chlorambucil + Obinuzumab vs Chlorambucil + Rituximab) la pacienții adulți cu comorbidități (CIRS ≥7), regimul Obinuzumab a arătat o ORR mai mare [78% vs 65%, p [22-27].
BCR implică o secvență în cascadă de activare a unui număr de sisteme kinazice cu un punct intermediar cheie - activarea Bruton-tirozin kinazei (BTK) și a fosfoinozitol-3-kinazelor (PI3Ks). Acestea din urmă duc la activarea protein kinazei B (ACT), a kinazelor reglate extracelular ERK 1 și 2, a factorilor nucleari kB (NF kB) și a celulelor T activate (NFAT).
Inhibitori antiapoptici [29-32]
Limfocitele maligne din CLL exprimă în mod semnificativ proteina anti-apoptoptică BCL-2 și în același timp sunt deosebit de sensibile la inhibarea BCL-2. Venetoclax (ABT-199) este un inhibitor foarte selectiv BCL-2 care se leagă de, inhibă și inactivează proteinele antiapoptotice. Venetoclax este aprobat de EMA (2016). ca monoterapie la pacienții cu LLC recurentă, stare de mutație nefavorabilă și nepotrivită pentru tratamentul cu inhibitori BCR. Spre deosebire de inhibitorii BCR, Venetoclax induce remisii profunde cu un procent ridicat de negativitate MRD. În 2018, FDA și EMA au aprobat Venetoclax ca a doua linie pentru toți pacienții cu LLC, indiferent de statutul lor, pe baza studiului de fază III MURANO (venetoclax + rituximab vs rituximab + bendamustin). Rezultatele au arătat SFP 84,9% vs 36,3%, cu niveluri remarcabile de negativitate MRD 62,4% vs 13,3%, care au rămas persistente chiar și la 10 luni după încetarea tratamentului. Regimurile pe bază de Venetoclax au un potențial enorm, cu o rată ridicată de negativitate MRD pe termen lung și capacitatea de a reduce riscul de rezistență.
Noile medicamente pentru manipularea terapeutică a pacienților cu LLC sunt rezultatul progreselor în cunoștințele teoretice în biologia bolii. Noile clase de medicamente (anticorpi anti-CD20, BTK, PI3K și inhibitori BCL-2) au schimbat radical strategia de tratament, egalând șansele de risc crescut cu alți pacienți cu profil de risc favorabil. Rezultatele lor de neatins au făcut ca decenii de regimuri de chimioterapie să fie istorice. Cu toate acestea, supraviețuirea ridicată de peste 15 ani la pacienții cu LLC în stadiu incipient tratați numai cu chimioterapie nu a fost încă atinsă. Este nevoie de timp pentru o evaluare reală a eficacității noilor medicamente și a importanței acestora în îmbunătățirea prognosticului și supraviețuirii pacienților cu LLC.
- Leucemia cronică - când este posibil să se vindece
- Troxevasin Gel pentru varice, umflarea membrelor și insuficiență venoasă cronică 2% x40
- Capsule Troxevasin pentru varice, umflarea membrelor și insuficiență venoasă cronică 300 mg
- Capsule Troxevasin pentru varice, edem la nivelul membrelor și insuficiență venoasă cronică 300
- Diaree cronică în diabet, pot rămâne gravidă de o persoană cu diabet