Conf. Dr. Vanya Yurukova, MD
Departamentul de boli pulmonare, MU-Sofia, MHATB „Sf. Sofia” EAD, Sofia
Astmul este o boală cronică eterogenă, ale cărei forme severe sunt în mare parte necontrolate. Astmul neutrofil este încă în studiu și necesită o terapie inovatoare eficientă. O abordare personalizată ar îmbunătăți controlul astmului cu biomarkeri - predictori de fenotipuri/endotipuri, răspuns la tratamentul țintit și alte opțiuni terapeutice.
Cuvinte cheie: astm, neutrofile, tratament
Astmul este eterogen în ceea ce privește severitatea, istoria naturală și răspunsul la tratament, iar această eterogenitate reflectă mecanismele de bază. În ciuda simptomelor similare, pacienții pot răspunde diferit la același tratament. Prin urmare, este necesar să se aplice medicamente precise pentru a schița un tratament țintit destinat endotipului pacientului.
În ultimul deceniu, s-au acumulat multe dovezi pentru astmul endotip Th2 (T2-înalt). Au fost dezvoltate tratamente biologice pentru a viza citokinele T2 pentru astmul alergic sau eozinofilic sever.
Pe de altă parte, endotipul He-T2 (Th2-low) este încă slab studiat și nu este aprobat pentru tratament țintit. Astmul non-T2 (Th2-scăzut) nu este neobișnuit și, potrivit unor cercetători, este observat la 50-75% dintre pacienții cu astm [1,2]. Alți autori au descoperit că majoritatea pacienților (> 90%) au prezentat dovezi ale bronșitei neutrofile și că fenotipul eozinofilic a fost observat după reducerea steroizilor inhalatori (ICS) la reexaminarea sputei. Majoritatea astmului non-T2 este neutrofil.
Astmul neutrofil (HA) este definit ca astm fără prezența markerilor de inflamație de tip 2, în care, aplicând citometrie cantitativă a sputei, neutrofilele sunt de 40-76% [3] .
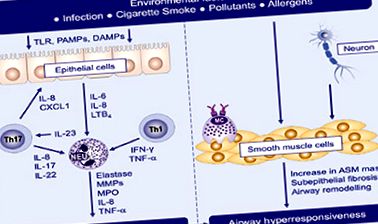
Tipul neutrofil al inflamației căilor respiratorii este observat după expunerea la ozon, particule de praf, infecții, endotoxine aeriene, fumat și substanțe chimice atunci când sunt exprimați receptori asemănători taxonilor (TLR). Analiza sputei în HA a constatat o expresie crescută a receptorilor imuni înnăscuti (TLR2, TLR4 și CD14) și citokinele proinflamatorii (IL-8 și IL-1ß) [4]. Activarea TLR induce trecerea la răspunsul Th1 și Th17, ducând la generarea de IL-8, IL-1ß, IFN γ și TNF-α [5,6] (Fig. 1). Niveluri ridicate de mediatori activi neutrofili precum IL-8, elastază neutrofilă, MMP-9, IL-17A, LTB4, GMCSF și TNF-α în sânge, lichidul bronhoalveolar (BAL) și epiteliul bronșic au fost demonstrate în HA.
Figura 1: Mecanismul inflamației neutrofile și hiperreactivității bronșice în astmul non-T2 [6]
Strategia pentru astmul neutrofil
Endotiparea este importantă pentru a reevalua doza de ICS. Simptomele clinice severe, rezistența relativă la ICS, hiperreactivitatea bronșică crescută și lipsa dovezilor de inflamație T2 (de exemplu, eozinofile normale în sânge și/sau spută, IgE serică sau FeNO) sau un număr ridicat de neutrofile în spută nu sunt motive suficiente pentru astmul -T2 [ 7] .
Tratament non-farmacologic
Renuntarea la fumat
Fumatul duce la creșterea nivelului de IL-17A și neutrofile în biopsiile endobronșice la pacienții fumători cu astm, comparativ cu nefumătorii [8]. Încetarea fumatului a fost asociată cu o îmbunătățire semnificativă a FEV1 și o reducere a numărului de neutrofile din spută în astm, comparativ cu cei care fumează în continuare.
Dieta saraca in grasimi
Au fost identificate mai multe gene (de exemplu S100P și S100A16) a căror expresie este crescută la astmatici după consumul de alimente bogate în calorii și bogate în grăsimi [9], care sunt susceptibile de a media acumularea de neutrofile în căile respiratorii. O dietă bogată în grăsimi comparativ cu o dietă cu conținut scăzut de grăsimi a fost asociată cu creșterea neutrofilelor din spută și creșterea expresiei mARN a receptorului Toll-like 4 și scăderea răspunsului bronhodilatator.
Pierderea în greutate la obezitate
Într-un studiu randomizat care a implicat pacienți cu astm bronșic obez și sever, un program de scădere în greutate de 6 luni (printr-o combinație de dietă hipocalorică, sibutramină și orlistat) a dus la îmbunătățiri semnificative ale controlului astmului și FVC, reducerea zilelor simptomatice și utilizarea medicamentelor de salvare și a vizitelor de urgență în comparație cu strategiile fără pierderea în greutate [10] .
Chirurgia bariatrică arată o reducere semnificativă a markerilor sistemici ai inflamației, incluzând proteina C-reactivă foarte sensibilă și leptina la pacienții cu și fără astm, dar fără modificări în IL-6, IL-8, TNF-α și GM-CSF [11] .
Termoplastie bronșică
Termoplastia bronșică îmbunătățește controlul astmului, VED, rezultatele chestionarelor privind calitatea vieții, procentul de zile fără simptome și reducerea consumului de droguri de salvare, exacerbări severe, vizite la secțiile de urgență și zilele ratate de la serviciu/școală [12] . Această metodă este utilizată la astmatici necontrolați cu simptome persistente, exacerbări frecvente și hiperreactivitate bronșică severă (cu PC20 Tratamentul farmacologic
Reducerea dozei de corticosteroizi
HA prezintă un răspuns slab la corticosteroizi. Întreruperea sau reducerea ICS la două treimi dintre pacienții non-eozinofili cu astm (spută cu eozinofile) [13] .
Bronhodilatatoare
Adăugarea unui antagonist muscarinic cu acțiune lungă (DDMA) și a unui beta-agonist cu acțiune lungă (DDBA) la ICS prelungește timpul până la prima exacerbare, îmbunătățește funcția pulmonară și simptomele [7]. Mai multe studii au demonstrat efectul DDBA în reducerea numărului de neutrofile din spută și a IL-8 în astmul ușor, dar o meta-analiză ulterioară a arătat că DDBA nu a avut efecte antiinflamatoare semnificative clinic.
Tratamentul infecțiilor
La pacienții cu neutrofilie infecțioasă, identificarea agentului patogen poate ajuta la alegerea antibioticelor.
Identificarea anomaliilor genei de conducere transmembranară a genei fibrozei chistice (CFTR) și utilizarea unui nebulizator salin hipertonic în gestionarea bronșitei neutrofile recurente în astmatici atent selecționați poate fi de asemenea utilă [14]. .
În infecțiile cu astm recurent, pacienții trebuie testați pentru deficiența imunoglobulinei. Înlocuirea imunoglobulinei poate îmbunătăți controlul astmului prin reducerea exacerbărilor infecțioase recurente [15] .
Claritromicina în astmul sever refractar reduce numărul de IL-8 și neutrofile din spută, dar nu îmbunătățește funcția pulmonară și controlul astmului.
În studiul AZISAST, pacienții cu astm bronșic sever la doze mari de ICS + DDBA, cu antecedente de exacerbări severe, au fost randomizați la tratament suplimentar cu azitromicină (250 mg zilnic de trei ori pe săptămână) sau placebo. Într-un subgrup predefinit cu astm sever non-eozinofil, azitromicina a fost asociată cu semnificativ mai puține exacerbări pe o perioadă de 26 de săptămâni.
În studiul clinic AMAZES, care a comparat adăugarea de azitromicină (500 mg de trei ori pe săptămână) cu placebo timp de 48 de săptămâni la pacienții cu astm simptomatic, a existat o reducere semnificativă a incidenței exacerbărilor totale (moderate și severe) și îmbunătățirea calitatea vieții (AQLQ) [16]. Nu s-au observat evenimente adverse semnificative, inclusiv pierderea auzului și QTc prelungit, la subiecții tratați cu azitromicină.
Sunt necesare mai multe cercetări pentru a investiga efectele imunomodulatoare ale macrolidelor pe termen lung cu doze mici.
Alți agenți terapeutici
În inflamația neutrofilă, un antagonist al receptorilor leucotrienelor (CysLTR1) prezintă un mod dependent de doză de inhibare a formării superoxidului, producția de LTB4 și eliberarea de elastază din neutrofilele activate in vitro.
Teofilina promovează apoptoza neutrofilelor și eozinofilelor in vitro prin reducerea proteinei anti-apoptotice Bcl-2, inhibă neutrofilele pentru a genera specii reactive de oxigen și reduce chimiotaxia neutrofilelor.
Roflumilast, un inhibitor al fosfodiesterazei-4, adăugat la ICS, reduce bronhoconstricția și inflamația căilor respiratorii, reduce numărul de eozinofile și neutrofile, nivelurile de TNF-α, îmbunătățește FEV1 în astmul ușor până la moderat.
Statinele sporesc efectele antiinflamatorii ale ICS în astm. Acest efect este mediat de inducerea indoleaminei 2,3-dioxigenazei (o enzimă degradantă a triptofanului) despre care se crede că este un imunomodulator al celulelor T.
Terapia vizată
Antagonist al receptorilor chemokinei cu motive C-X-C (CXCR2)
Receptorii chemokinelor CXC leagă IL-8 și joacă un rol important în migrarea neutrofilelor la locul inflamației. Un antagonist selectiv al CXCR2, SCH527123, a redus semnificativ numărul de neutrofile din spută și sânge la pacienții cu HA severă și a fost asociat cu semnificativ mai puține exacerbări. Într-un studiu al AZD5069 la un alt antagonist electiv CXCR2, nu au fost observate beneficii semnificative.
Golimumab, un anticorp monoclonal uman împotriva TNF-a, a fost studiat într-un studiu randomizat, dublu-orb, controlat cu placebo, multicentric la pacienți cu astm sever necontrolat. Nu s-au observat diferențe între tratament și grupurile placebo în principalele obiective primare, FEV1 și numărul exacerbărilor severe de astm. Într-o analiză post-hoc (la pacienții cu o reversibilitate a FEV1 ≥12% din valoarea inițială), golimumab a fost asociat cu exacerbări mai puțin severe. În timpul studiului au fost observate evenimente adverse grave, cum ar fi tuberculoza, șocul septic și tumori maligne.
Etanercept este o proteină recombinantă sintetică a receptorului TNF care se leagă de IgG1 Fc și blochează TNF. Tratamentul cu Etanercept a îmbunătățit semnificativ hiperreactivitatea bronșică, FEV1 și simptome și ACQ la pacienții cu astm sever refractar la steroizi.
Terapia este sigură și bine tolerată.
Brodalumab este un anticorp monoclonal împotriva receptorului IL-17. Acesta a fost studiat într-un studiu randomizat, controlat cu placebo, de fază IIa, la pacienți cu astm bronșic moderat până la sever, pe terapie numai cu ICS. În săptămâna 12, brodalumab nu a prezentat beneficii semnificative statistic în administrarea ACQ, FEV1 sau CDBA. A existat o îmbunătățire a scorului ACQ la o doză de 210 mg numai la reversibilitate ridicată (creștere postbronchodilator FEV1≥20%) [17] .
Tratamentul cu anakirna, un antagonist al receptorilor IL-1, experimental la cobai, previne pierderea indusă de infecția virală a expresiei receptorului de ARNm M2 și previne hiperreactivitatea in vitro a segmentului traheal.
Într-un alt studiu efectuat pe voluntari sănătoși, tratamentul pe termen scurt cu anakirna a redus semnificativ neutrofilele din spută, IL-1β, IL-6 și IL-8 după lipopolizaharidă inhalată, comparativ cu placebo.
Blocarea IL-6 poate fi o potențială țintă terapeutică. În prezent, nu există date disponibile privind studiile clinice cu intervenție anti-IL6 în astm.
Un studiu pilot a arătat că IFN-y recombinant nebulizat a redus semnificativ eozinofilele BAL, dar nu și neutrofilele. Tratamentul nebulizat cu IFN-β, la începutul infecției virale a căilor respiratorii superioare, îmbunătățește VED, crește CXCR10 seric și reduce nivelul CCL4 în spută.
IFN-α subcutanat îmbunătățește, de asemenea, FEV1, reduce eozinofilele din sânge, reduce utilizarea medicamentelor de salvare, vizitele de urgență și permite o reducere a dozei de glucocorticoizi la pacienții cu astm bronșic persistent necontrolat sever [18]. .
Inhibitori ai tirozin kinazei
Imatinibul inhibă tirozin kinaza, induce apoptoza mastocitară și este utilizat pentru tratarea anumitor malignități hematologice. Imatinib îmbunătățește hiperreactivitatea bronșică și reduce încărcarea mastocitelor căilor respiratorii în astmul sever [19] .
Inhibitor al proteinei activatoare a 5-lipoxigenazei (FLAP)
Leucotriena B4 (LTB4) este unul dintre mulți mediatori inflamatori secretați ai neutrofilelor, unde proteina activatoare a 5-lipoxigenazei (FLAP) joacă un rol cheie în formarea lor. Când este tratat cu un inhibitor FLAP, GSK2190915 la pacienții cu astm este redus semnificativ
LTB4 în spută, dar nu există nicio diferență în numărul sau procentul de neutrofile din spută în comparație cu placebo.
LC28-0126 are proprietăți antiinflamatorii și antinecrotice cu specii țintă de oxigen reactiv în mitocondrii [20]. Tratamentul cu
LC28-0126 a redus semnificativ numărul total de celule, neutrofile, IL-4, IL-5, IL-13 și IL-17 în fluid BAL indus de ovalbumin-lipopolizaharidă la șoareci și îmbunătățit hiperactivitatea bronșică.
IL-23
Interleukina-23 (IL-23) este o citokină heterodimerică secretată în principal de celule dendritice, macrofage și eozinofile, care este implicată în dezvoltarea celulelor Th17, activitatea IL-17A și, respectiv, neutrofilele căilor respiratorii. Risankizumab (BI 655066) este un IgG1 Mab îndreptat împotriva subunității p19 a IL-23. Într-un studiu clinic controlat cu placebo de 24 de săptămâni în astmul moderat, Risankizumab nu a îmbunătățit controlul astmului sau al frecvenței exacerbărilor.
În ultimul deceniu, înțelegerea noastră despre patobiologia astmului a suferit o schimbare de paradigmă, cu o mai mare recunoaștere a eterogenității și endotipurilor. Strategia pentru endotiparea și tratamentul componentelor individuale (inflamație neutrofilă sau hiperreactivitate bronșică) este crucială pentru pacienți. Studii suplimentare care evaluează mediatori inflamatorii Th17 și Th1, kinaze, molecule de semnalizare și mușchi neted pot oferi noi opțiuni terapeutice.
- Abordarea terapeutică la pacienții cu diabet zaharat de tip II și sindrom coronarian acut
- Abordare holistică a alergiilor și intoleranțelor alimentare - Atopia-Bg
- TOP 5 uleiuri esențiale pentru perimenopauză și menopauză Healthy You
- Sirakov Pri; Levski; nu vor exista cratime, virgule sau puncte
- Fibrele ajută la complicațiile sarcinii