Vaccinul împotriva tuberculozei Vaccillus Calmette-Guerin (BCG) are efecte benefice heterologice împotriva infecțiilor fără legătură. Baza acestor efecte a fost slab studiată la om. Un studiu randomizat controlat cu placebo a constatat că vaccinarea BCG a indus o reprogramare epigenetică genomică extinsă a monocitelor și a prevenit infecția experimentală cu o tulpină atenuată a vaccinului împotriva febrei galbene. Reprogramarea epigenetică a fost însoțită de modificări funcționale care indică imunitatea antrenată. Reducerea viremiei este puternic asociată cu o creștere a IL-1β, o citokină heterologă asociată cu inducerea imunității antrenate, dar nu cu un răspuns IFNγ specific. Importanța IL-1β pentru inducerea imunității antrenate a fost confirmată de studii genetice, epigenetice și imunologice. În concluzie, BCG induce reprogramarea epigenetică în monocitele umane in vivo, urmată de reprogramarea funcțională și protecția împotriva infecțiilor virale fără legătură, cu un rol cheie pentru IL-1β ca mediator al răspunsurilor imune.
O scurtă istorie a vaccinului BCG în Bulgaria 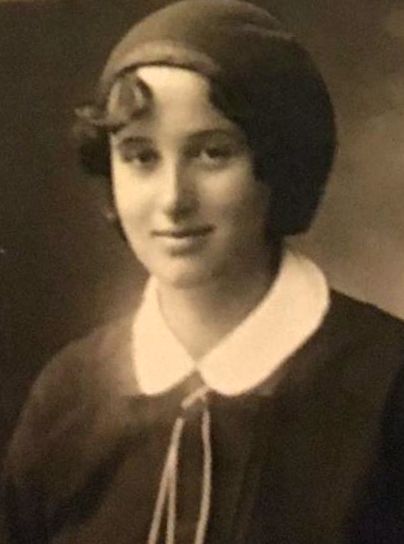
Bulgaria este a doua țară din lume după Japonia care a introdus vaccinarea obligatorie BCG - în 1951 - și astăzi peste 180 de țări beneficiază de experiența bulgară. Din 1991, laboratorul bulgar este unul dintre cele trei laboratoare din lume care sunt aprobate de Organizația Mondială a Sănătății (OMS) ca furnizor al UNICEF.
Creatorul vaccinului BCG din Bulgaria se numește Dr. Srebra Rodopska. S-a născut la 17 aprilie 1913 la Sofia. După ce fratele ei mai mic a murit de oreion, dr. Rodopska a decis să apeleze la medicamente. După absolvire, a început să lucreze la actualul Institut de Cercetare în Epidemiologie.
În 1948 a plecat la Paris împreună cu soțul ei - prof. Tasho Tashev, specialist în medicină internă. Timp de un an s-a specializat la Institutul Pasteur, unde a creat un vaccin francez viu împotriva tuberculozei. Ea a transportat-o în Bulgaria și a adaptat-o folosind un vaccin rusesc sub-tulpină - 374A.
Dr. Rodopska a primit recunoaștere din partea comunității științifice mondiale în timpul primei conferințe tehnice de la Geneva din 1956.
Ea trăiește până la vârsta de 93 de ani, iar rezultatele muncii sale științifice au păstrat sănătatea și viețile a milioane de oameni din întreaga lume.
În 2020, marea întrebare pentru vaccinul BCG este dacă ajută împotriva pandemiei Kovid-19. Vaccinarea obligatorie a scutit Bulgaria de o răspândire mai mare a noului coronavirus în țară? Previne BCG infecția prin creșterea imunității noastre? Întrebări la care nu există niciun răspuns până acum, doar presupuneri.
Introducere - BCG
Bacillus Calmette-Guerin (BCG) este o tulpină de vaccin viu atenuată a Mycobacterium bovis care protejează împotriva infecțiilor micobacteriene precum tuberculoza și lepra și a fost utilizată până în prezent de aproape un secol (Colditz și colab., 1994; Zumla și colab., 2013). Interesant este că vaccinul BCG are, de asemenea, efecte protectoare heterologice împotriva infecțiilor fără legătură: mai multe studii epidemiologice au arătat că vaccinarea la naștere duce la reducerea mortalității infantile (Hirve și colab., 2012; Kristensen și colab., 2000; Moulton și colab., 2005) ., Roth și colab., 2005). Aceste efecte benefice ale BCG au fost validate în studii randomizate controlate și mortalitatea redusă pare a fi datorată în principal protecției împotriva sepsisului neonatal și a infecțiilor respiratorii (Aaby și colab., 2011; Biering-Schrensen și colab., 2012; Roth și colab., 2004).). S-a demonstrat că vaccinarea cu BCG protejează împotriva mortalității în modele experimentale de infecții non-micobacteriene la șoareci (rezumat în Blok și colab., 2015). În cele din urmă, BCG este utilizat ca imunoterapie nespecifică pentru cancer, cu instalații BCG pentru cancerul vezicii urinare provocând efecte imunostimulatoare care încetinesc progresia tumorii (Han și Pan, 2006).
Au fost propuse două tipuri de mecanisme imunologice pentru a media aceste efecte. În primul rând, celulele de memorie CD4 și CD8 pot fi activate într-un mod independent de antigen (de exemplu, prin citokine stimulate de infecția secundară), un proces numit imunitate heterologă (Berg și colab., 2002; Berg și colab., 2003; Lertmemongkolchai și colab. ., 2001, Mathurin și colab., 2009). În al doilea rând, vaccinarea BCG provoacă modificări ale histonelor și reprogramarea epigenetică a monocitelor umane la locurile promotor ale genelor care codifică citokinele inflamatorii precum TNFA și IL6, ducând la un răspuns imun înnăscut mai activ după restimulare, un proces numit imunitate antrenată. ., 2016). Cu toate acestea, amploarea efectelor BCG asupra modificărilor histonice la nivelul genomului rămâne necunoscută. Mai mult, în timp ce studiile epidemiologice descrise sugerează în mod clar efecte heterologice de protecție ale BCG, studiile experimentale controlate la om pentru a stabili baza imunologică pentru aceste observații rămân excepționale și rolul potențial al imunității instruite în medierea acestor efecte nu a fost evaluat.
Un studiu recent a investigat efectele vaccinării BCG asupra modificărilor histonice la nivelul genomului induse în monocitele circulante prin vaccinarea BCG. Modificările funcționale cauzate de BCG în monocite au fost ulterior examinate și au fost studiate efectele vaccinării BCG asupra parametrilor virali, serologici și imunologici după vaccinul împotriva febrei galbene (YFV). YFV este o tulpină de virus atenuată care poate fi detectată în fluxul sanguin după vaccinare, făcându-l un model ideal pentru infecția virală experimentală la om. Arătăm că vaccinarea BCG reduce nivelul viremiei YFV după vaccinare și că acest efect se corelează cu inducerea răspunsurilor citokinice indicative ale imunității antrenate, cu un rol crucial în producerea și eliberarea IL-1β.
Articole similare:
Rezultatele studiului BCG
Figura 1: Schimbarea indusă de vaccin BCG în genomul H3K27ac în monocite
Cele mai multe modificări induse de vaccinarea BCG în regiunile promotor implică receptori asociați cu proteinele G și protein kinaze, indicând efectul extins al BCG asupra remodelării moleculelor de transducție a semnalului (Tabelul S3). În consecință, BCG induce creșterea H3K27ac în mai multe căi de semnalizare importante, inclusiv PI3K/AKT (fosfatidilinozitol 3-kinază), receptorul factorului de creștere epidermic (EGFR), factorul de creștere fibroblast (FGF) și căile de semnalizare a factorului endotelial vascular (EEG). ) (genele reglementate implicate în aceste căi pot fi găsite în Tabelul S4). Interesant este că genele cum ar fi genele legate de AKT1, MAPK și PI3K, care s-au dovedit a fi regulatori majori în formarea imunității instruite cu β-glucan, par a fi importante în formarea imunitară antrenată de BCG (Cheng et al., 2014) ., Saeed și colab., 2014) (Figura 1D; Tabelul S4). Genele direct implicate în răspunsul inflamator și producția de citokine prezintă, de asemenea, creșterea H3K27ac după vaccinarea BCG. Interesant este faptul că receptorul lipoproteinelor cu densitate scăzută oxidat (oxLDL), OLR1, un marker al aterosclerozei care s-a arătat anterior că induce un fenotip proinflamator pe termen lung în monocite (Bekkering și colab., 2014), este de asemenea reglementat diferențial3 în vaccinul BCG.
Secvențierea ARN a fost, de asemenea, efectuată pe aceleași probe, dar așa cum era de așteptat și așa cum s-a arătat anterior (Novakovic și colab., 2016; Saeed și colab., 2014), nu au fost găsite diferențe majore. Acest lucru indică faptul că monocitele antrenate sunt pregătite epigenetic pentru a răspunde (transcriptiv) diferit la un stimul secundar (de exemplu, stimulare ex vivo), dar că în repaus nu prezintă un program de transcripție modificat.
Reprogramarea epigenetică este însoțită de modificări funcționale induse de BCG
Figura 2: BCG induce imunitate antrenată in vivo
Vaccinarea BCG reduce viremia în febra galbenă
Figura 3: Vaccinarea BCG reduce viremia împotriva febrei galbene
Creșterea nespecifică a producției de IL-1β după vaccinarea cu BCG este o corelație de protecție împotriva viremiei împotriva febrei galbene
S-a stabilit apoi dacă inducerea reacțiilor citokinice ex vivo asociate cu imunitatea antrenată, după cum sa menționat anterior, s-a corelat cu viremia febrei galbene. Creșterea după vaccinare în producția de TNFα și IL-6 nu se corelează cu viremia (figurile 4A și S4A). În contrast, capacitatea crescută de producție a IL-1β după vaccinarea BCG a prezis puternic viremia mai mică după infecția cu febră galbenă ulterioară (Figurile 4A și 4B). Printre alte citokine, inducerea IL-10 la stimularea cu Candida albicans a arătat, de asemenea, o corelație negativă cu viremia (Figurile 4A, 4B și S4A). Interesant, viremia nu s-a corelat cu inducerea răspunsurilor celulare specifice la YFV de către BCG, măsurată prin producția de IFNγ de către PBMC (Figurile 4C și S4B). În plus, nu s-a găsit nicio corelație între concentrațiile de viremie și Th17 ale citokinelor IL-17 și IL-22 (Figura S4A). Acest lucru este remarcabil deoarece inducerea răspunsurilor CD8 + și polifuncționale CD4 + a fost observată după vaccinarea BCG (Figura S2) (Boer și colab., 2015; Kleinnijenhuis și colab., 2012). Concentrațiile de titruri ale anticorpilor care neutralizează anticorpii nu s-au corelat nici cu inducerea citokinelor (nici înnăscută, nici adaptativă) (Figura 4D).
Figura 4: Introducerea IL-1β se corelează negativ cu viremia febrei galbene
Diferențele epigenetice afectează viremia în febra galbenă
Pe lângă corelația cu inducerea citokinelor, se determină corelația modificărilor epigenetice cauzate de BCG și viremia febrei galbene. Pentru a face acest lucru, voluntarii prezentați în Figura 1 au fost împărțiți într-un grup de respondenți la vaccin BCG (R, viremie maximă a febrei galbene CT> 36) și non-răspunsori (NR, CT BCG: Polimorfismele genetice din genele IL-1β modulează un răspuns imun antrenat
Figura 6: Rolul IL-1β în imunitatea antrenată
Modificările epigenetice mediază formarea imunității antrenate de IL-1β
CONCLUZII DIN STUDIILE BCG
Studii recente au arătat că adaptarea funcțională a celulelor imune înnăscute după infecție sau vaccinare, care este indusă de reprogramarea epigenetică, este responsabilă pentru memoria imunitară înnăscută de facto, numită și imunitate antrenată (Netea și colab., 2016). Vaccinarea BCG este cunoscută de mult timp ca fiind asociată cu o mortalitate mai mică la copiii vaccinați, efect care nu poate fi atribuit pe deplin protecției împotriva tuberculozei, dar acest lucru se datorează probabil protecției împotriva sepsisului neonatal și a infecțiilor respiratorii. Deși s-a raportat că această protecție heterologă se datorează cel puțin parțial inducerii imunității antrenate (Kleinnijenhuis și colab., 2012), o evaluare cuprinzătoare a programelor epigenetice induse de BCG nu a fost făcută până în prezent. Există, de asemenea, dovezi ale efectelor protectoare ale imunității instruite induse de BCG asupra infecțiilor fără legătură la om.
Acest studiu descrie modificările epigenetice cauzate de scara genomului BCG la monocitele umane. Markerul histonei H3K27ac a fost ales pentru a fi studiat deoarece este asociat cu starea „activă” a cromatinei atât la promotorii genei, cât și la potențatori. În plus, a existat anterior o relație puternică între modificările H3K27ac și H3K4me3 în timpul imunității antrenate, H3K27ac fiind cea mai dinamică trăsătură (Saeed și colab., 2014). Dintre genele care prezintă H3K27ac crescut, a fost identificată îmbogățirea genelor care codifică proteinele implicate în semnalizarea celulară, precum și inflamația: citokine și chemokine, căile EGFR și VEGF. În plus, calea PI3K/AKT s-a dovedit a fi reglementată și acest lucru este susținut de studii recente care demonstrează implicarea sa în inducerea imunității antrenate de BCG și β-glucan (Arts și colab., 2016; Cheng și colab., 2014).). Profilul epigenetic indus de BCG prezintă asemănări strânse cu imunitatea antrenată indusă de β-glucan in vitro (Saeed și colab., 2014), sugerând că există un răspuns imun antrenat nuclear la stimulii induși de diferiți stimuli.
Reprogramarea epigenetică a monocitelor indusă de vaccinarea BCG este însoțită de răspunsuri semnificativ modificate ale celulelor imune înnăscute. Acest proces este clar ilustrat aici de producția inflamatorie mai mare de citokine (TNFα, IL-1β, IL-6) de PBMC de către voluntarii vaccinați cu BCG comparativ cu indivizii tratați cu placebo. În acest caz, stimularea PBMC (și a monocitelor nu foarte purificate) a fost aleasă pentru a imita situația clinică in vivo cât mai aproape posibil. În plus, în timp ce modificările epigenetice observate la monocitele foarte purificate sunt indicative pentru inducerea unor programe imune antrenate prin vaccinarea BCG, efectele funcționale măsurate în PBMC pot fi, de asemenea, afectate de prezența limfocitelor. Diferențele în producția de citokine după vaccinarea BCG au fost observate în studii anterioare atât la copii (Jensen și colab., 2015), cât și la adulți (Kleinnijenhuis și colab., 2012). Amplitudinea răspunsurilor citokinice care indică inducerea imunității antrenate în prezentul studiu este puțin mai pronunțată decât în studiile anterioare, probabil din cauza diferențelor în loturile BCG (Biering-Sorensen și colab., 2015).
Important, diferențele semnificative în markerii epigenetici au fost evidente la monocitele de la respondenții BCG (viremie scăzută cu febră galbenă) și BCG care nu au răspuns (viremie mai mare). H3K27ac la nivelul receptorului NOD2 (care este esențial pentru inducerea imunității antrenate induse de BCG [Kleinnijenhuis și colab., 2012]) se corelează cel mai bine cu răspunsul BCG. Căile imune suplimentare asociate cu producția de citokine și răspunsurile imune înnăscute s-au dovedit a fi importante.
Una dintre cele mai remarcabile observații a fost făcută în studiul corelaților de protecție împotriva viremiei. S-a sugerat anterior că dezvoltarea cicatricilor după vaccinarea BCG poate fi utilizată ca marker pentru efectele nespecifice și supraviețuirea copiilor (Garly și colab., 2003; Roth și colab., 2005). Cu toate acestea, toți voluntarii vaccinați cu BCG au dezvoltat o cicatrice de dimensiuni comparabile (0,5-0,7 cm) și nu s-a observat nicio asociere între protecție. În plus, modificarea pliabilă a răspunsurilor heteroloage ale celulelor T (producerea IFNy, IL-17 și IL-22) după vaccinarea BCG nu a arătat nicio asociere cu viremia YFV. În schimb, creșterea producției de IL-1β după BCG s-a corelat puternic cu viremia mai mică după administrarea YFV, în timp ce producția altor derivați de citokine monocite a arătat o corelație mai mică. Acest lucru sugerează că inducerea producției de IL-1β stimulată de agenții patogeni nelegați, care este un indicator al răspunsurilor imune antrenate, mai degrabă decât răspunsurile celulare adaptive, astfel cum este evaluată prin producția specifică de IFNγ indusă de stimul, este responsabilă pentru protecția indusă de BCG împotriva infecției virale.
Deoarece producția neregulată de IL-1β joacă un rol major în etiologia multor boli autoinflamatorii, capacitatea IL-1β de a induce imunitate antrenată poate fi un eveniment central în fiziopatologia acestor tulburări. Aceasta necesită cercetări suplimentare, deoarece poate fi o țintă terapeutică pentru aceste boli. De fapt, studiul însoțitor de Bekkering și colab. al consorțiului INTRIM prezintă un fenotip neregulat al imunității antrenate în monocitele izolate de la pacienții cu sindrom hiper IgD (Bekkering și colab., 2018), un sindrom autoinflamator bine cunoscut.
Concluzie: vaccin BCG și imunitate antrenată
În concluzie, un studiu recent a raportat un program epigenetic larg indus de vaccinarea BCG la om, ducând la activarea crescută a monocitelor circulante. În plus, vaccinarea BCG s-a dovedit a proteja împotriva infecției virale fără legătură într-un model experimental de infecție umană, iar răspunsurile medicamentoase IL-1β, care indică imunitatea antrenată indusă, au fost raportate a fi cel mai fiabil corelat. Studii suplimentare de validare genetică și imunologică arată că calea IL-1 este crucială pentru inducerea eficientă a imunității antrenate la om și poate fi importantă atât pentru vaccinare, cât și pentru fiziopatologia bolilor autoinflamatorii.
- Angelina Jolie atât de slabă și în același timp atât de feminină - Pagina 6 BG-Mamma
- Anemie în timpul sarcinii
- Ani Stoycheva Acum este momentul perfect pentru a privi în interior - Ancestral Superfoods
- Anna Netrebko a fost externată din spital după tratamentul cu COVID-19
- 4 semne zodiacale pe care le poți mânca oricând Ziarul STRUMA
