- Informații
- Simptome
- Tratamente
- Cercetare
- Bibliografie
- Comentarii
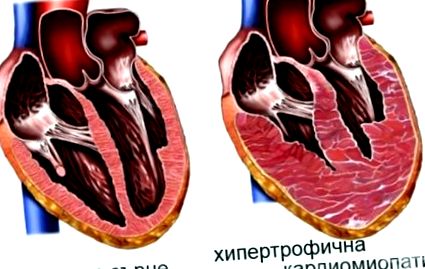
Cardiomiopatia hipertrofică este o boală genetică care este de obicei moștenită într-un mod autosomal dominant cu penetrare variabilă și expresie variabilă. Boala are simptome complexe și consecințe potențial dăunătoare pentru pacienți și familiile acestora.
Tulburarea are performanțe variabile și are o incidență ridicată a morții subite. De fapt, cardiomiopatia hipertrofică este principala cauză de deces subit cardiac la copii și adolescenți. O trăsătură distinctivă a tulburării este hipertrofia miocardică, care este inadecvată, adesea asimetrică, și apare în absența unui stimul evident al hipertrofiei. Această hipertrofie poate apărea în orice zonă a ventriculului stâng, dar implică adesea septul interventricular, ducând la obstrucția fluxului prin tractul de ieșire ventricular stâng.
Boala sistemului cardiovascular, care se caracterizează printr-o creștere patologică a dimensiunii mușchiului cardiac și dezvoltarea cardiomiopatiei hipertrofice non-obstructive, se numește alte cardiomiopatii hipertrofice.
Cardiomiopatia non-obstructivă, în funcție de ce parte a miocardului cardiac este afectată, poate fi:
- hipertrofie asimetrică de sept
- hipertrofie apicală
Hipertrofia septică asimetrică implică septul inimii care îl împarte în stânga (atriul stâng și ventriculul stâng) și dreapta (atriul drept și ventriculul drept). Și în hipertrofia apicală, este implicat vârful inimii.
Epidemiologie
Cardiomiopatia hipertrofică a fost raportată la 0,5% din populația ambulatorie trimisă pentru ecocardiografie. Prevalența generală este scăzută și se estimează că apare la 0,05-0,2% din populație. Dovezile morfologice ale bolii sunt detectate prin ecocardiografie la aproximativ 25% din rudele de gradul I ale pacienților cu alte cardiomiopatii hipertrofice. Testarea genetică este încă în stadiile incipiente ale cercetării, dar poate fi utilizată pentru a identifica membrii familiei asimptomatice cu aceeași mutație ca și probandul (indicele de caz).
Cardiomiopatia hipertrofică este puțin mai frecventă la bărbați decât la femei. Cu toate acestea, modelul moștenirii genetice este autosomal dominant, fără orientare sexuală. Modificările factorilor genetici, hormonali și de mediu pot duce la o probabilitate mai mare de identificare la bărbați, simptome crescute sau un grad mai mare de obstrucție a scurgerilor ventriculare stângi, cu constatări mai vizibile la examinarea fizică.
Cardiomiopatia hipertrofică apare de obicei la o vârstă mai mică la femei. Femeile tind să fie mai simptomatice și sunt mai susceptibile de a fi invalidate de simptome decât bărbații.
În general, boala are un vârf bimodal. Cea mai comună prezentare este în a treia decadă a vieții, dar poate fi prezentă la persoanele de toate vârstele, de la nou-născuți până la adulți.
La copii, cazurile ereditare se găsesc în intervalul de vârstă, de la nou-născuți (adică bebeluși născuți încă) la adulți. Frecvența maximă în aceste cazuri este în a doua decadă a vieții.
La adulți, frecvența de vârf este în a treia decadă de viață, majoritatea cazurilor apărând în intervalul de vârstă cuprins între decada a treia și a șasea de viață.
Etiologie
Motivul dezvoltării unei alte cardiomiopatii hipertrofice este cel mai adesea genetic. Cardiomiopatia hipertrofică este moștenită. Cardiomiopatia hipertrofică familială se manifestă ca o boală autozomală dominantă în aproximativ 50% din cazuri. Unele forme, dacă nu toate, sporadice ale bolii pot fi cauzate de mutații spontane.
Cel puțin 6 gene diferite pe cel puțin 4 cromozomi sunt asociate cu cardiomiopatie hipertrofică și până acum au fost identificate peste 50 de mutații diferite. Cardiomiopatia hipertrofică familială este o boală genetică eterogenă, deoarece poate fi cauzată de defecte genetice la mai mult de 1 locus.
Există o largă variație în expresia fenotipică a mutației unei gene, cu variabilitate a simptomelor clinice și gradul de hipertrofie exprimat. Variabilitatea fenotipică este asociată cu diferențe de genotip, cu mutații specifice asociate cu simptome specifice, gradul de hipertrofie și prognosticul.
Datele leagă cinetica anormală a calciului miocardic de cauza hipertrofiei miocardice inadecvate și de caracteristicile specifice ale bolii, în special la pacienții cu tulburări funcționale diastolice. Cinetica anormală a calciului miocardic și fluxurile anormale de calciu dintr-o creștere a numărului de canale de calciu duc la o creștere a concentrației intracelulare de calciu, care la rândul său poate duce la hipertrofie și tulburări celulare.
Alte cauze posibile ale altor cardiomiopatii hipertrofice includ următoarele:
- stimulare simpatică anormală - răspunsul crescut al inimii la producția excesivă de catecolamine sau scăderea absorbției neuronale a norepinefrinei poate provoca
- arterele coronare intramurale îngroșate anormal - acestea nu se dilată normal, ducând la ischemie miocardică; aceasta progresează către fibroza miocardică și hipertrofie compensatorie anormală.
- ischemie subendocardică - aceasta este asociată cu anomalii ale microcirculației cardiace, care epuizează rezervele de energie necesare pentru eliberarea de calciu în timpul diastolei. Ischemia subendocardică duce la interacțiunea permanentă a elementelor contractile în timpul diastolei și la creșterea rigidității diastolice.
- anomalii structurale cardiace - acestea includ configurația catenoidă a septului, ceea ce duce la hipertrofie și tulburare a celulelor miocardice.
Patogenie
Ca descrieri inițiale ale cardiomiopatiei hipertrofice, caracteristica care a atras cea mai mare atenție a fost gradientul de presiune dinamică prin tractul de ieșire ventricular stâng. Gradientul de presiune pare a fi legat de o îngustare suplimentară a unui tract de ieșire deja mic (deja îngustat prin hipertrofie asimetrică septală marcată și posibil prin poziția anormală a valvei mitrale) din mișcarea sistolică anterioară a valvei mitrale împotriva septului hipertrofiat.
Trei explicații pentru mișcarea valvei mitrale anterioare sistolice sunt propuse după cum urmează:
- valva mitrală este trasă spre sept prin contracția mușchilor papilari, care apare din cauza localizării anormale a valvei și a hipertrofiei septale, modificând orientarea mușchilor papilari
- valva mitrală este împinsă spre sept datorită poziției sale anormale în tractul de ieșire
- valva mitrală este atrasă spre sept datorită presiunii mai mici care apare atunci când sângele este expulzat cu viteză mare printr-un tract de ieșire îngustat (efect Venturi)
Majoritatea pacienților cu alte cardiomiopatii hipertrofice au funcție diastolică anormală (indiferent dacă există sau nu un gradient de presiune), care perturbă umplerea ventriculară și crește presiunea de umplere, în ciuda cavității ventriculare normale sau mici. Acești pacienți au cinetică anormală a calciului și ischemie subendocardică, care sunt asociate cu hipertrofie profundă și proces miopatic.
În plus, există dificultăți în umplerea ventriculului, deoarece miocardul este mai greu și nu se relaxează bine după sistolă. Consecințele acestui fenomen apar în timpul unui efort considerabil, deoarece inima nu poate crește cantitatea de sânge necesară pentru activitatea musculară. Dacă acest defect este prea mare, sângele stagnează în vasele pulmonare și crește presiunea în țesuturi. Dacă presiunea este prea mare, acest lucru duce la edem pulmonar.
Pereții dilatați duc la lipsa de oxigenare (ischemie) a mușchiului, în absența unei anomalii a arterelor coronare. Mecanismul acestei ischemii este dublu: lipsa aportului de oxigen din arterele coronare „calibrate” pentru dimensiunea normală a mușchilor și alterarea arteriolelor intramusculare, al căror perete este îngroșat și lumenul este redus. De asemenea, poate exista, de asemenea, o cale intramiocardică a arterei coronare („punte musculară”), care duce la fragmentarea arterei coronare cu fiecare contracție a ventriculilor. Aceasta nu este teoretic o problemă, deoarece cea mai mare parte a fluxului coronarian se află în diastolă, dar reducerea calibrului arterial poate fi prelungită și în diastolă.
Poate exista o modificare a reglării tensiunii arteriale care nu crește suficient cu exercițiile fizice (sau chiar poate scădea). În mod similar, scurgerea valvei mitrale este frecventă, probabil secundară obstrucției intraventriculare.
Fibrele musculare sunt aranjate într-un mod anarhic comparativ cu o inimă normală, contracția având un randament mai mic. Această dezorganizare duce la modificări ale proprietăților electrofiziologice, care sunt un substrat pentru aritmiile ventriculare potențial periculoase.
Tablou clinic
Simptomele unei alte cardiomiopatii hipertrofice pot include dificultăți de respirație, sincopă și presincopă, angină, palpitații, ortopnee, dispnee nocturnă paroxistică, insuficiență cardiacă congestivă, amețeli și moarte cardiacă subită.
În mai mult de 80% din cazuri, aritmia care provoacă moartea subită este fibrilația ventriculară. Multe dintre aceste cazuri degenerează în fibrilație ventriculară din aritmii atriale rapide, cum ar fi fibrilație, tahicardie supraventriculară sau sindromul Wolf-Parkinson-White, în timp ce altele rezultă din tahicardie ventriculară și colaps hemodinamic cardiac scăzut.
Respirația scurtă este cel mai frecvent simptom reprezentativ, care apare la aproximativ 90% dintre pacienții simptomatici. Respirația scurtă se datorează în mare măsură presiunii crescute de umplere diastolică a ventriculului stâng (și transmiterii acestor presiuni crescute înapoi în circulația pulmonară). Presiunea crescută de umplere a ventriculului stâng este cauzată în principal de compromisul diastolei ca urmare a hipertrofiei ventriculare pronunțate.
Sincopa este un simptom foarte frecvent rezultat din frecvența cardiacă insuficientă în timpul efortului sau din aritmia cardiacă. Apare mai frecvent la copii și adulți tineri cu dimensiuni mici ale ventriculului stâng și dovezi ale tahicardiei ventriculare în monitorizarea ambulatorie.
Alternativ, sincopa poate fi cauzată de aritmii sau tahicardii sau bradicardie. Unii pacienți au funcții anormale ale nodului sinusal, ceea ce duce la „sindromul sinusal bolnav” cu tahiaritmii și bradiaritmii sau bradiaritmii severe alternante.
Sincopa și presincopa identifică pacienții cu risc crescut de moarte subită și necesită tratament urgent și tratament agresiv.
Simptomele tipice ale anginei sunt destul de frecvente la pacienții cu cardiomiopatie hipertrofică neobstructivă și pot apărea în absența aterosclerozei coronare detectabile. Relaxarea diastolică afectată și consumul semnificativ crescut de oxigen miocardic sunt cauzate de hipertrofia ventriculară, care duce la ischemie subendocardică, în special în timpul exercițiului.
Palpitațiile inimii sunt frecvente. Acestea rezultă din aritmii precum accident vascular cerebral atrial și ventricular prematur, pauze sinusale, fibrilație atrială, fibrilație atrială, tahicardie supraventriculară și tahicardie ventriculară.
Ortopneea și dispneea nocturnă paroxistică sunt semne timpurii ale insuficienței cardiace congestive și, deși relativ rare, sunt observate la pacienții cu cardiomiopatie hipertrofică severă. Acestea sunt rezultatul afectării funcției diastolice și a presiunii crescute de umplere a ventriculului stâng. Ortopneea și dispneea nocturnă paroxistică rezultă din congestia venoasă pulmonară.
Amețeala este frecventă la pacienții cu cardiomiopatie hipertrofică cu gradienți crescuți de presiune prin tractul de ieșire al ventriculului stâng. Este exacerbată de exerciții fizice și poate fi exacerbată de hipovolemie după niveluri ridicate de efort sau pierderi crescute de lichid insensibil (de exemplu, în timpul căldurii intense).
Amețeala poate fi, de asemenea, secundară hipotensiunii arteriale și a perfuziei cerebrale scăzute. Aritmiile instabile cauzează adesea simptome de amețeli, vertij și presincopă, în timp ce aritmiile persistente sunt mai susceptibile de a duce la sincopă, colaps și/sau moarte subită cardiacă.
Diagnostic
Diagnosticul cardiomiopatiei hipertrofice neobstructive se face după un istoric bine luat pe baza datelor pacientului și a reclamațiilor acestuia, a examenului fizic și instrumental. Examenul fizic constă în examinare, palpare, auscultație (ascultare) și percuție. Din auscultarea inimii, se poate detecta un zgomot cu maxim un punct pe marginea sternului stâng, amplificat prin exercițiu.
Metodele de cercetare instrumentală neinvazivă care se efectuează sunt:
- electrocardiogramă (ECG) - oferă informații despre hipertrofia ventriculară stângă, pseudoinfarctul cu dinți Q profuni și unda T negativă precordial datorită hipertrofiei septale, aritmiilor ventriculare
- ecocardiografie - prezintă o creștere asimetrică a dimensiunii septului
- Plasarea Holter - pentru o electrocardiogramă de 24 de ore
- radiografia inimii și a plămânilor
Diagnosticul cardiomiopatiei hipertrofice se bazează pe o serie de caracteristici ale procesului bolii. Deși ecocardiografia, cateterizarea cardiacă sau imagistica prin rezonanță magnetică cardiacă sunt utilizate pentru diagnosticarea bolii, alte considerații importante includ ECG, testarea genetică (deși nu este utilizată în principal pentru diagnostic) și orice antecedente familiale de cardiomiopatie hipertrofică sau bruscă inexplicabilă la persoanele altfel sănătoase.
În funcție de faptul dacă perturbarea anatomiei cardiace normale determină obstrucția fluxului sanguin din ventriculul stâng al inimii, cardiomiopatia hipertrofică poate fi clasificată ca fiind obstructivă sau neobstructivă. Varianta neobstructivă este cardiomiopatia hipertrofică apicală, numită și sindromul Yamaguchi sau hipertrofia Yamaguchi, descrisă mai întâi la persoanele de origine japoneză.
Cateterismul cardiac este oferit în cazuri controversate, dar este rar necesar. La indivizii sănătoși, în timpul sistolei ventriculare, presiunile din aortă și ventriculul stâng se egalizează și valvele aortice se vor deschide. La subiecții cu cardiomiopatie hipertrofică obstructivă (sau stenoză aortică, deoarece fenomenul este același), se va crea un gradient de presiune (diferență) între ventriculul stâng și aortă, presiunea nivelului ventricular fiind mai mare decât presiunea aortică. Acest gradient reprezintă gradul de obstrucție care trebuie depășit pentru ca ventriculul să expulge sângele pe care îl conține către aortă.
Rețineți că diagnosticul de boală coronariană concomitentă este complicat de numeroasele rezultate fals pozitive atât în timpul unui test de efort, cât și în timpul unui examen miocardic în cazul cardiomiopatiei hipertrofice.
Tratament
Scopul tratamentului în alte cardiomiopatii hipertrofice este de a reduce gradientul de presiune dintre ventriculul stâng și aorta și simptome precum dificultăți de respirație, dureri în piept și sincopă.
Tratamentul medicamentos este eficient la majoritatea pacienților. În cazul aritmiilor cardiace atriale, se utilizează beta-blocante, verapamil (un blocant al canalelor de calciu), diuretice, antiaritmice și chiar terapie anticoagulantă. Beta-blocantele reduc obstrucția ejecției printr-un efect direct asupra mușchiului inimii (un deprimant al inotropismului). Încetinirea ritmului cardiac îmbunătățește, în plus, umplerea ventriculului și reducerea ritmului cardiac obținut face posibilă combaterea ischemiei. Verapamilul are efecte comparabile, dar tinde să scadă și mai mult tensiunea arterială, care poate fi dăunătoare.
Prevenirea morții subite se bazează pe utilizarea unui defibrilator automat implantabil, care va avea ca rezultat un șoc electric cu amplitudine redusă în cazul detectării unei aritmii ventriculare potențial grave. Acest tip de tratament este disponibil numai pentru pacienții despre care se crede că prezintă un risc crescut pentru această complicație.
În caz de deteriorare a funcției sistolice, este prescris un tratament specific pentru insuficiența cardiacă: convertirea inhibitorilor enzimei sau a antagoniștilor receptorilor angiotensinei II cu, dacă este necesar, diuretice.
Sporturile de nivel înalt sunt, în general, interzise din cauza riscului de moarte subită și se recomandă o activitate fizică moderată.
Ar trebui efectuată o examinare sistematică a fraților și copiilor persoanei afectate.
În cazuri mai severe, poate fi necesară ablația alcoolică a septului - o procedură non-chirurgicală în care alcoolul este injectat în vasele coronare. Scopul este de a ucide acest țesut „suplimentar”.
- O altă condrocalcinoză mcb M11
- O altă degenerare specificată a discului intervertebral mcb M51
- Despre Hashimoto, văzut dintr-un alt unghi - Forumuri
- Emma Stone și Andrew Garfield; ia o pauză; unul de la altul
- Un pensionar se laudă cu altul. Am învățat o dietă excelentă pentru potența sexuală