Dr. Rosen Mikhailov, Dr. Dilyana Stoeva, Dr. B. Pencheva
SMDL "RAMUS" Ltd.
Cuvinte cheie: fibroză hepatică, celule stelate hepatice, miofibroblaste, matrice extracelulară, fibrogeneză, fibrinoliză, citokine, matrice metaloproteinaze, inhibitori ai metaloproteinazei tisulare
La nivel global, fibroza hepatică este în creștere. Principalele motive pentru aceasta sunt alcoolismul, infecțiile virale cronice B și C, obezitatea hepatică nealcoolică și altele. Dintre factorii de risc, sexul și vârsta sunt mai importante. Dezvoltarea fibrozei hepatice are loc cu participarea diferitelor tipuri de celule (în formă de stea, miofibroblaste, celule Kupffer, celule Th2, neutrofile, macrofage etc.), componente proteice (elastină, acid hialuronic, proteoglicani, fibronectine etc.) și citofite. -a, PDGF, EGF, BFGF etc.). Indiferent de agentul patologic, fibrogeneza începe cu activarea celulelor stelate și transformarea lor în miofibroblaste capabile să sintetizeze și să secrete în principal colagen I, II și III. Creșterea matricei extracelulare este rezistată prin remodelare și fibrinoliză, cu sinteza metaloproteinazelor matricei (MMP 1-13). Pentru a continua fibrogeneza, diferite celule sintetizează inhibitori ai metaloproteinazei tisulare (TIMP-1 și TIMP-2). Noua abordare a tratamentului CF se bazează pe descoperirea mecanismelor celulare și moleculare ale patogeniei fibrozei hepatice.
Fibroza hepatică (IC) este etapa inițială de înlocuire a țesutului hepatic cu țesut conjunctiv. Este un proces de arhitectură dezorganizată a ficatului, însoțit de modificări anatomice și funcționale. Odată cu creșterea inițială a raportului dintre țesutul conjunctiv și țesutul celular hepatic, structurile lobulare sunt intacte.
Fibrele de colagen nou formate sunt delicate, predispuse la degradare. Pe măsură ce procesul patologic progresează, fibrele de colagen devin mai groase și mai dure, rezistente la degradare. Structura lobulară a ficatului este perturbată. Incidența fibrozei hepatice arată o tendință ascendentă constantă la nivel mondial [1-3]. Se dezvoltă ca rezultat al afectării hepatice cronice cauzate de alcool, hepatită cronică virală B și C, obezitate hepatică nealcoolică (NAFLD), boli autoimune, parazitare și metabolice și mai rar din toxine, medicamente (Metotrexat, Tolbutamidă), Wilson, fructozemie, galactozemie, hemocromatoză, boala Gaucher, echinococoză, hepatită sclerozantă primară, tromboză venoasă portală, obstrucție mecanică, expunere la substanțe chimice industriale, inclusiv soluții de curățare, vopsele cu aerosoli, diluanți de vopsea și altele Fibroza este un proces dinamic și progresiv. Din punct de vedere histologic, dezvoltarea sa este clasificată în etape separate:
- F0 - fără fibroză.
- F1 - fibroză abia marcată în zona portalului.
- F2 - fibroză moderată între zonele portale, dar fără distrugerea structurii lobulare.
- F3 - fibroză severă cu punți fibrocistice între zonele portal, între zonele portal și venele din centru.
- F4 - ciroza.
Ciroza este compensată inițial și poate fi clinic asimptomatică. Odată cu progresia fibrogenezei, ciroza duce la decompensare și la apariția complicațiilor hepatice: hipertensiune portală, ascită, icter, encefalopatie hepatică și carcinom hepatocelular primar [1,3,4]. Între 6-41% dintre bărbații care consumă alcool peste 40-50 g/zi și femeile care consumă alcool peste 20-30 g/zi dezvoltă fibroză după 10-15 ani [1,2]. În Europa, consumul de alcool crește, în special în rândul femeilor.
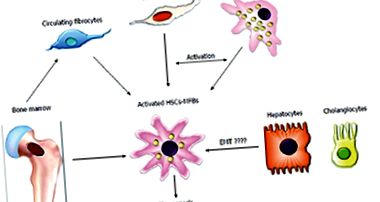
Figura 1: Originea miofibroblastelor hepatice (câte 13) [13]
Când ficatul este deteriorat, aceste celule intră într-o interacțiune complexă cu celulele vecine [13,16,17]. Celulele stelate hepatice, cunoscute și sub numele de celule perisinusoidale Ito sau lipocite, sunt pericite găsite în spațiul perisinusoidal al ficatului sau spațiul Disse. În repaus ele reprezintă 5-8% din numărul total de celule hepatice. Acestea stochează vit. Și, ca și retinoizii, sintetizează proteina acidă fibrilară glială. În condiții normale, acestea se află într-o stare latentă. Fibrocitele portal sunt celule în formă de fus de origine mezenchimală care suferă diferențierea miofibroblastică, în principal în afectarea hepatică colestatică [13,16,17]. Există cel puțin două subpopulații de miofibroblaste în afectarea hepatică cronică: derivați HSC (HSC-MFS) și celule mezenchimale portale. Unele miofibroblaste hepatice pot apărea din măduva osoasă derivată din celulele stem mezenchimale, care sunt celule stem multipotente, dar cel mai probabil reprezintă o populație diferită de fibrocitele de origine hematopoietică. Toate aceste tipuri de celule suferă modificări legate de proliferare, acumulare anormală și remodelare redusă a matricei extracelulare atunci când ficatul este deteriorat de diverși agenți.
Activarea rezultă din stimularea paracrină de către toate celulele vecine, inclusiv celulele Kupffer, hepatocitele, leucocitele și macrofagele. După activarea HSC, există o scădere a expresiei adipogenului (factorii lipogenetici). În același timp, o rețea complexă de semnale fibrogene autocrine/paracrine promovează transdiferențierea HSC și a altor celule în fenotipuri miofibroblastice. Proteinele sintetizate și secretate din diferite celule joacă un rol important în fibrogeneză. Cele mai puternice proteine sunt integrinele, care permit comunicarea între ECM și citoschelet. Există, de asemenea, o acumulare de alte proteine matrice, inclusiv elastină, hialuronat, proteoglicani și fibronectină (Fig. 2).
Figura 2: Modificări ale arhitecturii ficatului în fibroza avansată (1 fiecare) [1]
Specii de celule individuale exprimă diferite MMP-uri care arată activitate pe diferite substraturi:
- MMP-1 (sau colagenaza interstițială) este exprimată de celulele inflamatorii.
- MMP-2 (sau gelatinaza) este exprimată prin celule stea activate.
- MMP-3 (sau stromelizinele) sunt exprimate de celule inflamatorii și macrofage.
- MMP-8 este exprimat prin neutrofile și macrofage.
- MMP-9 este exprimat de celulele Kupffer și de macrofagele inflamatorii.
- MMP-13 este exprimat prin celule stelate și macrofage.
Echilibrul dintre MMP-2/TIMP-2 s-a dovedit a fi crucial pentru cifra de afaceri ECM28. Este posibil ca alte mecanisme inhibitoare ale MMP să contribuie la fibrinoliză. TIMP-urile sunt, de asemenea, reglementate de citokine și factori de creștere. Interesant este că TGFβ1, care inhibă activitatea colagenazei, este implicat în reglarea TIMP-1. Astfel, hemostaza depinde de un echilibru fin între MMP și TIMP. În plus, deoarece TIMP-1 are și efecte antiapoptotice asupra HSC-urilor, acestea induc fibrogeneza prin promovarea supraviețuirii celulelor fibrogene. Se disting următoarele trei etape:
- Faza preinflamatorie cu activare HSC prin hepatocite pe moarte.
- Faza inflamatorie când HSC-urile sunt stimulate în continuare să se diferențieze la miofibroblaste.
- Faza postinflamatorie, când miofibroblastele secretă citokine stimulante și componente ECM (Fig. 1).
Aceste citokine pot stimula atât miofibroblastele, cât și celulele stea, creând un feedback pozitiv care perpetuează procesul de fibrogeneză. Angiogeneza este un alt răspuns la afectarea hepatică cronică care duce la remodelarea sinusoidală [1,15,16]. Mulți mediatori angiogeni puternici sunt, de asemenea, implicați în remodelare.
Diagnosticul BSF se bazează pe:
- Biopsie hepatică.
- Tehnici de imagistică și biomarkeri serici neinvazivi.
Noua abordare a tratamentului CF se bazează pe descoperirea mecanismelor celulare și moleculare ale patogeniei fibrozei hepatice.
- Cauzele fibrozei pulmonare
- Cauze și mecanismul steatozei hepatice
- Colangita sclerozantă primară - etiologie, patogenie, tratament, prognostic
- Alimente adecvate pentru adolescenți
- Problemele de stomac se termină aici! Articole plătite