Conf. Dr. V. Sirakova
Deficiență de fier este foarte frecventă la pacienții cu insuficiență cardiacă. Aceasta afectează calitatea vieții și stabilește un prognostic mai prost în ceea ce privește internările și mortalitatea. Corecția sa are un efect clinic favorabil. Cardiologii ar trebui să cunoască și să caute și să trateze în mod curent carența de fier la pacienții cu insuficiență cardiacă, indiferent dacă au sau nu anemie.
Cuvinte cheie: insuficiență cardiacă, deficit de fier, fiziopatologie, comportament.
Deficitul de fier (IR) este o afecțiune frecventă care de obicei nu este recunoscută până când se dezvoltă anemia cu deficit de fier. În ultimul deceniu, având în vedere numeroasele funcții vitale ale fierului, am lucrat activ la semnificația sa clinică și la potențialul de influență.
Fierul este crucial în transportul (hemoglobina) și stocarea (mioglobina) oxigenului. Cu capacitatea sa de a trece de la un feron divalent la unul trivalent și invers, este un cofactor al enzimelor oxidative și un catalizator pentru multe reacții biochimice. Prin urmare, fierul este un oligoelement absolut necesar pentru metabolismul tuturor țesuturilor și pentru menținerea energiei celulare. Pe de altă parte, în concentrații mari, fierul este o otravă celulară, datorită căruia în corpul uman există un control strict de reglementare al homeostaziei sale [3,5] .
Pentru a înțelege fiziopatologia GD și posibilitățile de influență a acesteia, este necesar să reamintim metabolismul fierului în lumina descoperirilor de la începutul secolului.
Metabolismul fierului
Cantitatea totală de fier la bărbații adulți este de aproximativ 3,8 g, iar la femei - aproximativ 3 g, deoarece 2-2,4 g sunt în hemoglobină, aproximativ 1 g, legat sub formă netoxică de feritină, se depune în depozitele de deșeuri (ficat, splina, creierul osos) și 3-4 mg circulă în plasmă, legată în principal de transferina proteinei de transport și o fracțiune foarte mică legată de feritină. Cantitatea de fier din organism este reglată de absorbția acestuia prin enterocitele duodenale. Pierderea fierului este pasivă numai în descuamarea pielii, exfolierea celulelor epiteliale și pierderea minimă de sânge. Ca urmare, absorbția și pierderea a 1-2 mg de fier pe zi se realizează în mod normal. Macrofagele sistemului reticuloendotelial descompun eritrocitele vechi, iar fierul este returnat în măduva osoasă pentru nevoile de eritropoieză [1,5,6,11,13] .
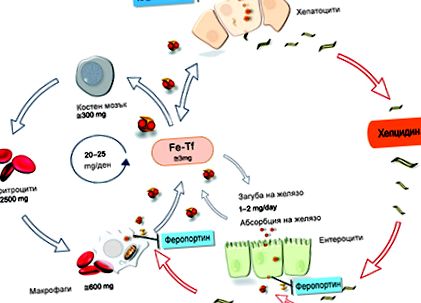
Metabolismul sistemic al fierului este controlat în principal de hepcidină și de receptorul său feroportină, și intracelular - de un complex de proteine care reglează fierul. Hepcidina este o proteină formată din 25 de aminoacizi care este sintetizată în principal în hepatocite. A fost izolat pentru prima dată din urină în 2000. Este un reactant al fazei acute a inflamației cu activitate antibacteriană și antifungică. Puțin mai târziu, s-a constatat că este un regulator major în metabolismul fierului [5,9]. Hpcidina circulantă interacționează cu celulele țintă ale receptorului transmembranar specific ferroportinei: enterocite și macrofage. Ferroportina este „tragerea” fierului din celule în circulație. Prin provocarea internalizării și degradării feroportinei, hepcidina reduce absorbția intestinală și concentrația de fier circulant în timp ce crește depozitele intracelulare (Fig. 1). Exprimarea hepcidinei de către hepatocite este supusă unei reglementări stricte pentru a optimiza și sincroniza metabolismul fierului. Scăderea conținutului de fier în depozitele de deșeuri, nevoile crescute de eritropoieză și hipoxie sunt principalii factori care suprimă producția de hepcidină, în timp ce inflamația are efectul opus [1,5,6,11,13] .
FIG. 1. Absorbția și reciclarea fierului (13. fiecare)
Clasificarea și diagnosticarea deficitului de fier (IR)
Există două tipuri de deficit de fier în corpul uman. Calea ferată absolută se caracterizează prin depozite de fier epuizate. În tractul gastrointestinal funcțional, există o cantitate normală de fier în corp, dar este „blocat” în depozite și nu poate fi îndepărtat de acolo pentru nevoile țesuturilor [1,6] .
Cauzele JD sunt numeroase: pierderea de sânge, alimentarea insuficientă sau utilizarea medicamentelor care interferează cu absorbția fierului (de exemplu inhibitori ai pompei de protoni), sarcina și alăptarea, donarea de sânge. În inflamația bacteriană, GD este un mecanism adaptiv pentru a limita creșterea microorganismelor. Cu toate acestea, este și o complicație a multor boli cronice: poliartrită reumatoidă, boală inflamatorie intestinală, insuficiență renală cronică, insuficiență cardiacă cronică (IC), boala Parkinson etc., indiferent dacă există sau nu anemie concomitentă [5,6] .
Simptomele GD sunt numeroase, dar nespecifice: slăbiciune, oboseală, iritabilitate, crampe, căderea părului, unghii fragile, sindrom Plummer Vinson, imunitate afectată, pagofagie, sindrom de picioare neliniștite. În dezvoltarea sa, calea ferată este cea mai frecventă cauză de anemie.
Constelația de laborator pentru studiul metabolismului fierului include fierul seric, transferrina, capacitatea totală de legare a fierului (TLC) și feritina [15]. Principalii indicatori de laborator pentru diagnosticul GD sunt: feritina 100 μg/l (deficit absolut) sau feritina de la 100 la 300 μg/l și saturația transferinei [6,10,11,14] .
Deficitul de fier în insuficiența cardiacă
Frecvență
Deficitul de fier este o afecțiune frecventă concomitentă în insuficiența cardiacă, indiferent dacă există sau nu anemie, definită ca hemoglobină sub 13 g/dl la bărbați și sub 12 g/dl la femei. Incidența TA în HF cu funcție de pompare suprimată variază de la 26% la 37%, de la 16% la 32% la pacienții fără anemie și de la 54% la 61% la pacienții cu anemie [4,5,8,10,13] . O analiză recent publicată a 1.506 pacienți cu IC din diferite țări a arătat că 50% dintre aceștia aveau TA [17]. Este mai frecvent la femeile în vârstă, IC mai avansat, niveluri mai ridicate de BNP, neurohormoni și citokine proinflamatorii, tensiune arterială scăzută, insuficiență renală concomitentă sau diabet. Se discută posibilitatea ca frecvența GD să fie chiar mai mare decât cea publicată, mai ales într-un cadru ambulatoriu, unde studiul parametrilor metabolismului fierului este de obicei omis. Până în prezent, nu există studii de amploare asupra căilor ferate în HF cu fracție de ejecție conservată [2,10,11,12,17] .
Cauze și fiziopatologie
Deficitul de fier (anemie) în IC poate fi cauzat de diverse cauze sau combinații ale acestora. Se poate dezvolta odată cu epuizarea treptată a depozitelor de fier din organism din cauza conținutului insuficient de fier în dietă, malabsorbție datorată edemului mucoasei duodenale, creșterea pierderilor de sânge atunci când se utilizează antiplachete trombocite sau anticoagulante. În ultimul deceniu, au apărut dovezi că inflamația cronică sistemică, care caracterizează sindromul HF, joacă un rol semnificativ în fiziopatologia GD. Citokinele proinflamatorii TNF α, IL 1 și IL 6 suprimă secreția de eritropoietină de către rinichi și sensibilitatea măduvei osoase la acesta, precum și reduc biodisponibilitatea fierului. Există date experimentale care stimulează, de asemenea, producția de hepcidină de către hepatocite și prin aceasta își realizează efectul asupra hematopoiezei [2,6,7,10,11,12,17] .
Deficitul de fier duce atât la reducerea transportului, cât și la reducerea utilizării oxigenului în miocard și în mușchiul scheletic (Fig. 2). Fierul este necesar pentru funcționarea normală a mitocondriilor ca cofactor al enzimelor aerobe pentru transferul de electroni și pentru producerea de ATP și energie în celulă. Capacitatea oxidativă a mușchilor scheletici este redusă proporțional cu întregul spectru al căii ferate. Acest mecanism participă la patogeneza plângerilor subiective ale pacienților cu oboseală, dificultăți de respirație și capacitate fizică limitată, care deseori nu corespund funcției ventriculare și dilatării cu semne de inflamație, matrice extracelulară mărită și disfuncție mitocondrială. Toate acestea se realizează pe fondul expresiei crescute la nivel local a eritropoietinei și hepcidinei. Astfel, calea ferată participă la progresia CH [2,6,7,12] .
FIG. 2. Efectul căii ferate asupra eritropoiezei și utilizării O2 (2 fiecare)
Prognoza
Studiile observaționale publicate în ultimul deceniu au arătat că TA determină o calitate a vieții mai slabă și o mortalitate mai mare la pacienții cu IC. Într-o analiză multivariată, GD (nu anemia) rămâne un predictor separat de deces (raport de risc 1,42/1,58), independent de alți predictori general acceptați, cum ar fi clasa NYHA, nivelul NT proBNT, incl. anemie [4,10,12] .
- Digoxin Sopharma (Digoxin) pentru insuficiență cardiacă I Prospectul I
- Deficitul de testosteron la bărbați - la ce duce
- Cetoacidoza diabetică - apare în deficitul absolut de insulină
- Îngrijirea pacienților cu insuficiență cardiacă în ambulatoriu Continuat din numărul 11
- Dieta pentru colită - 26 noiembrie 2017 - Blog - Site pentru distracție și agrement