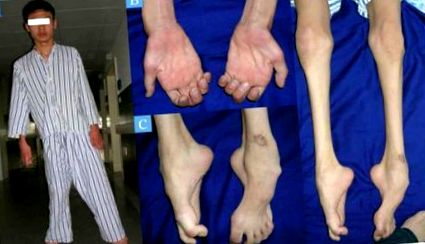
În plus, ICD G60.0 Neuropatia ereditară motorie și senzorială (NMS), numită și Boala Charcot-Marie-Tooth și atrofie musculară peroneală, include un grup mare de neuropatii (leziuni ale nervilor), care se caracterizează prin impactul lor asupra neuronilor aferenți (care trimit impulsuri către creier) și eferenți (care transmit impulsuri din creier către măduva spinării).
În aceste boli, una sau mai multe componente ale sistemului periferic autonom sau cranian (cranian)/spinal (spinal) sunt deteriorate. Ca urmare, persoanele afectate suferă de atrofie musculară progresivă și neuropatie senzorială a membrelor.
Boala Charcot-Marie-Tooth (CMT) este un grup eterogen din punct de vedere genetic și clinic caracterizat prin pierderea progresivă a masei musculare și simțul atingerii în diferite părți ale corpului.
Neuropatie motorie și senzorială ereditară (NMS):
Este o boală ereditară - dacă unul dintre părinți este bolnav Boala Charcot - Marie - Tooth, generația sa are șanse de 50% să dezvolte și boala.
Neuropatia motorie și senzorială ereditară a fost descrisă pentru prima dată în 1886 de Charcot și Marie în Franța și de Tooth în Anglia. Câțiva ani mai târziu, Dejerine și Sottas au descris o formă mai severă, neuropatică ereditară din copilărie.
Epidemiologie
CMT afectează 1 din 2500 de persoane și este cea mai frecventă boală a sistemului nervos periferic.
Incidența CMT 1 este de 15 persoane la 100.000 de locuitori; incidența CMT 1A este de 10,5 persoane la 100.000 de locuitori, sau 70% din CMT 1.
Incidența CMT 2 este de 7 persoane la 100.000 de locuitori.
Etiologie
Boala SMT este rezultatul mutațiilor care cauzează defecte ale proteinelor neuronale.
Impulsurile nervoase sunt conduse de un axon (o creștere lungă și subțire a unei celule nervoase) cu o teacă de mielină în jurul său. Cele mai multe mutații afectează teaca de mielină, dar unele afectează și axonul.
Cea mai comună mutație este duplicarea (dublarea) unei regiuni mari a brațului scurt al cromozomului 17, inclusiv gena PMP22.
Unele mutații afectează gena MFN2, care codifică o proteină mitocondrială. Celulele conțin un set specific de gene în nucleii și mitocondriile lor. În celulele nervoase, mitocondriile se mișcă de-a lungul axonilor lungi.
În unele forme ale bolii, mutațiile genei MFN2 duc la formarea unor zone mari de mitocondrii care nu se pot deplasa de-a lungul axonilor către sinapse, iar acest lucru interferează cu funcționarea sinapselor.
Alte celule găsite în Boala Charcot - Marie - Tooth, sunt celule Schwann, care formează teaca de mielină prin „înfășurarea” membranei lor plasmatice în jurul unui axon și formând o structură asemănătoare cu rolele. Neuronii, celulele Schwann și fibroblastele creează împreună un nerv funcțional. Celulele Schwann și neuronii schimbă semnale moleculare care reglează dezvoltarea și diferențierea celulelor nervoase.
În SMT, aceste semnale sunt întrerupte.
Rolul tecilor de mielină este legat de transmiterea mai rapidă a impulsurilor nervoase din celulele nervoase. Când teaca de mielină este deteriorată, semnalele nervoase sunt transmise mai lent și acest lucru poate fi detectat prin electromiografie. Cu toate acestea, atunci când axonul este deteriorat, acesta reduce potențialul de acțiune al mușchiului.
Tablou clinic
Simptomele atrofiei musculaturii peronee încep de obicei la sfârșitul copilăriei sau adolescenței. Unii pacienți nu prezintă simptome înainte de vârsta de 30-40 de ani.
Cel mai adesea primul simptom este căderea părții din față a piciorului (piciorul picăt). Se poate observa și îndoirea degetelor de la picioare.
Pierderea masei musculare la nivelul picioarelor inferioare poate da picioarelor aspectul unui „picior de barză” sau „sticlă inversată”.
Pe măsură ce boala progresează, poate apărea slăbiciune în mâini și antebrațe.
Pierderea senzației de atingere la picioare, glezne și picioare, precum și la mâini, este caracteristică diferitelor variante de atrofie musculară peroneală.
Atât formele precoce, cât și cele tardive ale bolii se caracterizează prin „pornirea și oprirea” contracțiilor musculare dureroase, spastice, care pot duce la dizabilități atunci când boala este activată.
O manifestare clasică a bolii sunt picioarele cu arc înalt (câine cavus). Receptorii senzoriali și proprioceptivi din brațe și picioare sunt deseori deteriorați, în timp ce receptorii de durere (nociceptorii) nu sunt afectați.
Utilizarea excesivă a brațului sau piciorului afectat poate activa simptome precum rigiditate și crampe musculare dureroase (crampe).
La unii pacienți, respirația poate fi afectată, precum și mușchii auzului, vederii, gâtului și umărului.
Scolioza (curbura coloanei vertebrale) este frecventă. Probabil sunt probleme gastro-intestinale - dificultăți de mestecat, de înghițire și de vorbire - cauzate de atrofia corzilor vocale.
Sarcina și stresul emoțional duc la agravarea bolii.
Pacienții cu neuropatie motorie și senzorială ereditară Trebuie evitate perioadele prelungite de imobilizare, deoarece imobilizarea exacerbează semnificativ simptomele NMSN.
Durerea neuropatică (afectarea structurii nervoase) este un simptom comun al bolii Charcot-Marie-Tooth. Durerea poate fi de la severă la insuportabilă și interferează cu activitățile zilnice.
Clasificare
Conform clasificării inițiale a bolii Charcot-Marie-Tutt, pacienții sunt împărțiți în două grupe principale:
- Grupa 1 a fost caracterizată printr-o rată scăzută de transmitere a impulsului nervos și dovezi ale neuropatiei hipertrofice demielinizante;
- Grupa 2 a fost caracterizată printr-o rată relativ normală de transmitere a impulsului nervos și degenerare axonală;
În 1975, Dyck a extins clasificarea:
Diagnostic
Diagnosticul se face pe baza:
- măsurarea vitezei de transmitere a impulsurilor nervoase (prin electromiografie)
- biopsie nervoasă
În CMT tip 1A, ultrasunografia de înaltă rezoluție a nervului median (n. Medianus) și a altor nervi periferici poate servi ca adjuvant la electrodiagnostic.
Persoanele cu CMT tip 1B au nervi medieni și vagi mai mari (nn. Vagi) decât persoanele sănătoase.
Imagistica prin rezonanță magnetică (RMN) a mușchilor extremităților inferioare este utilizată pentru a monitoriza evoluția bolii la pacienții cu această boală.
www.annalsofian.org
- Testele ADN. Testele ADN pot face un diagnostic definitiv, dar nu toți markerii genetici pentru neuropatia motorie și senzorială ereditară sunt încă cunoscuți.
Pentru a identifica semnele de slăbiciune musculară, pacientul trebuie să meargă pe călcâi sau să îndrepte o parte a piciorului împotriva unei forțe în direcția opusă.
Pentru a determina dacă există o pierdere a senzației, trebuie testate reflexele profunde ale tendonului care sunt reduse sau absente în această boală.
Istoria familiei indică, de asemenea, boala ca fiind Boala Charcot-Marie-Tutt este ereditar. Absența unui istoric familial nu exclude boala, dar permite excluderea altor cauze ale neuropatiei, precum diabetul sau expunerea la anumite substanțe chimice sau medicamente.
Tratament
Nu s-a dezvoltat încă niciun tratament pentru această boală, dar se fac studii experimentale cu doze mari de acid ascorbic (vitamina C).
Este foarte important pacienții cu SMT pentru a-și menține mușchii. Din acest motiv, se recomandă fizioterapie și activitate moderată, dar supraîncărcarea trebuie evitată. Kinetoterapeutul trebuie să pregătească un program de exerciții strict individual pentru fiecare pacient. Tulburările de mers pot fi corectate cu orteze speciale (proteze).
În ultimă instanță, se poate efectua o intervenție chirurgicală, pacientul alegând dacă își stabilizează picioarele sau corectează problemele progresive.
Manipulările includ îndreptarea și fixarea degetelor de la picioare, reducerea arcului piciorului și uneori îmbinarea oaselor articulației gleznei pentru a asigura stabilitatea.
Pacienții trebuie să ia măsuri de precauție suplimentare împotriva căderilor, deoarece fracturile (fracturile) durează mai mult timp pentru a se vindeca. În plus, imobilizarea (imobilizarea) în timpul tratamentului unei fracturi poate agrava boala.
Prognoza
Prognosticul pentru diferite tipuri de CMT variază și depinde de severitatea clinică.
În general, atrofia musculară peroneală este o neuropatie lent progresivă care poate duce la dizabilități datorate slăbiciunii și deformărilor musculare distale.
Deteriorarea activității motorii motorii în CMT 1A crește după vârsta de 50 de ani
În cazuri rare, implicarea n. phrenicus (nervul diafragmatic) poate provoca dificultăți de respirație.
Boala Charcot-Marie-Tut nu scurtează de obicei speranța de viață.
Prevenirea
Unele medicamente (de exemplu, vincristină, izoniazidă, paclitaxel, cisplatină și nitrofurantoină) cauzează leziuni ale nervilor și trebuie evitate.
Asociația Charcot-Marie-Tooth identifică medicamentul chimioterapic cu vincristină ca fiind cu risc ridicat și periculos, recomandând ca acesta să fie evitat de toți pacienții cu neuropatie motorie și senzorială ereditară, inclusiv cei fără simptome.
Exercițiul regulat este recomandat în limitele capacităților individului și mulți oameni rămân activi fizic.
Nu sunt recomandate restricții specifice de activitate.
Trebuie evitată obezitatea, deoarece îngreunează mersul.
ICD G60.0 Neuropatia ereditară motorie și senzorială (IMS) include, de asemenea Boala Dejerine-Sottas, de asemenea cunoscut ca si neuropatie hipertrofică la copii.
Boala Dejerine-Sottas:
Boala poartă numele lui Joseph Jules Dejerine și Jules Sottas - neurologi francezi care au descris-o prima dată. Condiția se caracterizează prin deteriorarea nervilor periferici și provoacă pierderea progresivă a masei musculare
Etiologie
Neuropatia hipertrofică la copii rezultă din defecte genetice fie în proteinele găsite în axoni, fie în proteinele conținute în mielină.
În special, mutațiile sunt în genele MPZ, PMP22, PRX și EGR2.
Boala este moștenită într-un mod autosomal dominant sau autosomal recesiv.
Tablou clinic
Manifestările inițiale ale neuropatiei motorii și senzoriale ereditare încep în copilărie, de obicei înainte de vârsta de trei ani. Dezvoltarea bolii este întârziată până la adolescență, după care poate progresa și provoca dizabilități severe.
Simptomele Boala Dejerine-Sottas sunt de obicei mai severe și progresive rapid decât alte forme de HMSC. Unii pacienți nu pot să meargă și să folosească un scaun cu rotile până la sfârșitul primului deceniu, în timp ce alți pacienți au nevoie doar de un baston, dar pe toată durata vieții.
Amorțeala, furnicăturile sau arsurile sunt de obicei primele simptome.
Slăbiciunea musculară este de obicei stabilită mai întâi în partea din spate a piciorului și apoi se răspândește în grupul muscular anterior.
Neuropatie hipertrofică la copii se caracterizează prin slăbiciune moderată până la severă la nivelul membrelor superioare și inferioare, precum și pierderea senzației, care se manifestă în principal la nivelul picioarelor inferioare și, de asemenea, la nivelul brațelor. Progresia bolii se poate manifesta prin pierderea masei musculare și scăderea tonusului muscular.
Pe măsură ce starea se agravează, slăbiciunea poate apărea și în mușchii brațului și antebrațului. Se poate dezvolta insuficiență respiratorie.
www.drfernandonoriega.com
Alte simptome care pot apărea odată cu Boala Degerin-Sotas, include:
- durere la nivelul membrelor
- curbura coloanei vertebrale
- deformarea degetelor tip "pasăre de pradă"
- deformări ale picioarelor
- ataxie (lipsa de echilibru și coordonare)
- areflexie periferică (reflexe întârziate sau absente)
- dezvoltarea lentă a abilităților motorii în timpul copilăriei.
Simptomele mai puțin frecvente includ:
- mișcări reduse ale ochilor
- alte probleme oculare, cum ar fi nistagmusul (mișcarea spontană, nereglementată a globilor oculari) și anisocoria (elevii au diametre diferite)
- pierderea ușoară a auzului.
Diagnostic
Imagistica este principala modalitate de detectare a modificărilor.
Imagistica prin rezonanță magnetică (RMN) este metoda preferată pentru imagistica diagnostic, care determină gradul de implicare a nervilor.
Nervii afectați par a fi îngroșați din cauza hipertrofiei țesutului conjunctiv interstițial (conferind nervilor un aspect special de „cap de ceapă”), iar inflamația sau filtrarea neurală și/sau perineurală se găsesc, de asemenea.
Ganglionii limfatici din jurul coloanei vertebrale pot fi, de asemenea, afectați, împreună cu ganglionii limfatici situați de-a lungul nervilor cranieni.
Studiile electrofiziologice în sindromul Degerin-Sotas arată polineuropatie specifică, cu prezența demielinizării fibrelor nervoase senzoriale și motorii, ceea ce duce la o reducere semnificativă a excitabilității și a vitezei impulsurilor nervoase.
www.ajnr.org
Tratament
Nu există un tratament specific pentru Boala Dejerine-Sottas.
Terapia este de susținere și vizează ameliorarea simptomelor.
Abordarea față de pacienți este multidisciplinară și include specialiști în neurologie, fizioterapie, ortopedie, terapie ocupațională.
Chirurgia gleznei/piciorului sau încălțăminte specială cu un suport bun pentru gleznă poate ajuta la corectarea sau stabilizarea articulațiilor legate de mers.
Nevralgia poate fi tratată cu antidepresive triciclice sau cu alte medicamente precum carbamazepina sau gabapentina.
Consilierea genetică poate fi utilă pentru familiile și persoanele cu această boală.
O altă condiție din ICD G60.0 este Sindromul Roussy-Levy.
Sindromul Roussy-Levy:
Este o boală genetică rară care determină pierderea progresivă a masei musculare. Este cauzată de mutații ale genelor care codifică proteinele, care sunt necesare pentru funcționarea tecii de mielină a neuronilor, care la rândul său reduce viteza semnalelor nervoase, ceea ce duce la o restricție a mișcării musculare.
Acest sindrom afectează copiii și adulții și este moștenit într-un mod autosomal dominant. Nu există nici un leac cunoscut.
Boala a fost descrisă pentru prima dată de Gustave Roussy și Gabrielle Levy.
Simptomele bolii sunt rezultatul afectării nervilor și a dezvoltării atrofiei musculare progresive. Afectarea neurologică poate duce la dispariția reflexelor tendinoase (areflexie), pierderea senzației în fibrele senzoriale distale și scăderea excitabilității musculare în timpul stimulării curente galvanice și faradice.
Pierderea progresivă a masei musculare duce la slăbiciune musculară la nivelul extremităților inferioare; ataxie (lipsa de echilibru și coordonare); câine cavus (picior concav); tremurări posturale (legate de postură) sau statice (tremurături) ale membrelor superioare; cifoscolioză (curbură neobișnuită a coloanei vertebrale înainte și lateral - cifoză combinată cu scolioză); deformarea piciorului.
Aceste simptome duc adesea la apariția întârziată a mersului, pierderea coordonării și a echilibrului, lăsarea frontului piciorului și deformări osoase ale piciorului.
Cele mai frecvente simptome sunt Sindromul Roussy-Levy apar în timpul copilăriei și progresează lent până la vârsta de 30 de ani, când simptomele pot dispărea la unii pacienți.
Sindromul Roussy-Levy este asociat cu două mutații genetice - duplicarea (dublarea) genei PMP22, care poartă „instrucțiuni” pentru producerea proteinei de mielină periferică 22 - o componentă majoră a învelișului de mielină. Cealaltă mutație este o mutație fără sens (un tip de mutație punctuală) din gena MPZ care codifică proteina zero de mielină, o proteină structurală majoră în mielina periferică.
Examenul neurologic a relevat o rată redusă de transmitere a impulsului nervos și caracteristici histologice ale neuropatiei hipertrofice demielinizante. Electromiografia prezintă semne de leziuni neurogene ușoare, în timp ce biopsia nervoasă prezintă formațiuni în formă de ceapă.
Formarea unui nerv funcțional are loc cu ajutorul neuronilor, celulelor Schwann și fibroblastelor. Semnalele moleculare sunt schimbate între celulele Schwann și neuroni, care reglează dezvoltarea și diferențierea celulelor nervoase. În sindromul Rusi-Levy, aceste semnale sunt întrerupte.
Cercetările clinice se pot concentra asupra bolii, în timp ce diagnosticul este confirmat de teste genetice care vizează detectarea mutațiilor.
Sindromul Roussy-Levy nu duce la moarte, iar speranța de viață este normală. Cu toate acestea, din cauza pierderii musculare progresive, pacienții pot avea nevoie de echipamente ortopedice speciale sau de un scaun cu rotile.
Examenul neurologic a relevat o rată redusă de transmitere a impulsului nervos și caracteristici histologice ale neuropatiei hipertrofice demielinizante. Electromiografia prezintă semne de leziuni neurogene ușoare, în timp ce biopsia nervoasă prezintă formațiuni în formă de ceapă.
Formarea unui nerv funcțional are loc cu ajutorul neuronilor, celulelor Schwann și fibroblastelor. Semnalele moleculare sunt schimbate între celulele Schwann și neuroni, care reglează dezvoltarea și diferențierea celulelor nervoase. Când Sindromul Rusi-Levy aceste semnale sunt întrerupte.
Cercetările clinice se pot concentra asupra bolii, în timp ce diagnosticul este confirmat de teste genetice care vizează detectarea mutațiilor.
Sindromul Roussy-Levy nu duce la moarte, iar speranța de viață este normală. Cu toate acestea, din cauza pierderii musculare progresive, pacienții pot avea nevoie de echipamente ortopedice speciale sau de un scaun cu rotile.
- Neuropatie de mână când lucrați pe computer
- Motor alalia - tratament BG-Mamma
- Intoxicarea ereditară cu simptome de miere, diagnostic, tratament Competente pentru sănătatea iLive
- Alimente adecvate pentru adolescenți
- Problemele de stomac se termină aici! Articole plătite