Anticorpi (imunoglobuline) sunt proteine care aparțin fracțiunii gamma globulinice. Acestea sunt produse de celulele plasmatice sub un stimul antigenic.
Structura imunoglobulinelor
Fiecare imunoglobulină conține cel puțin o structură de bază numită monomer. Monomerul este compus din patru lanțuri polipeptidice - două L ușoare (ușoare) și două H grele (grele), care sunt legate prin aproximativ 20-25 legături disulfură între siturile cisteinei. Legăturile disulfură pot fi localizate între lanțuri - între lanțurile H și L sau intracaten, formând domeniile lanțurilor individuale. Structura monomerului imunoglobulinei seamănă cu litera latină Y. Diferite imunoglobuline au un număr diferit de monomeri, iar formula generală a anticorpilor este (H2 L2) n. Lanțurile ușoare conțin 214 aminoacizi, iar în lanțurile grele numărul lor este de aproximativ două ori mai mare - aproximativ 440. Imunoglobulinele sunt de fapt glicoproteine, deoarece mai multe lanțuri oligozaharidice sunt atașate la lanțurile lor grele.
Lanțuri ușoare și grele
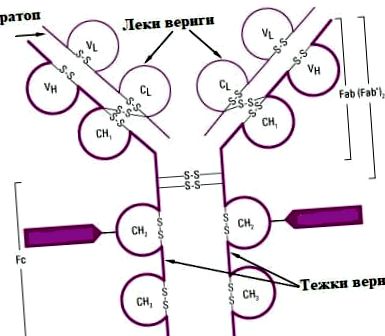
Regiunea polipeptidică cu o grupă amino terminală formează regiunea variabilă (V) cu o compoziție de aminoacizi foarte variabilă în moleculele individuale care participă la formarea sitului de legare a antigenului (paratop), iar regiunea cu o grupare carboxil reprezintă regiune constantă (C) cu aminoacizi relativ constanți. În lanțurile ușoare cele două regiuni au o lungime egală, în timp ce în lanțurile grele regiunea constantă este de trei ori mai lungă și formează o structură spațială a trei domenii constante. Un domeniu variabil este observat în regiunea variabilă. O regiune limitată a regiunii variabile, compusă dintr-un număr mic de aminoacizi, se caracterizează printr-o variabilitate ridicată a compoziției și se numește regiune hipervariabilă. Aceste secțiuni sunt 3 pentru fiecare circuit. Acestea sunt zonele care formează centrul activ (paratopul) anticorpilor. Caracteristici ale structura imunoglobulinelor arată că fiecare moleculă de imunoglobulină are cel puțin două situsuri active și este divalentă, cu două situsuri de legare a antigenului.
Structura imunoglobulinelor
- Structura primară - este determinată de secvența de aminoacizi a regiunilor variabile ale lanțurilor ușoare și grele.
- Structura secundară - este plierea anticorpilor pentru a forma structuri globulare numite domenii. Domeniile sunt segmente compuse din aproximativ 110 aminoacizi. Fiecare lanț ușor formează două domenii, iar lanțul greu patru.
- Structura terțiară - se exprimă printr-o modificare a structurii domeniului, deoarece capătă forma unui cilindru compus din două straturi de proteine, care sunt conectate între ele printr-o legătură disulfură.
- Structura cuaternară - determinată de prezența mai multor lanțuri polipeptidice. La imunoglobuline, care sunt polimeri (IgA, IgM), se observă legarea monomerilor prin lanțuri J. Aceste lanțuri pentru glicoproteine non-moleculare care sunt atașate la lanțurile grele.
Anticorpii aparțin superfamiliei imunoglobulinei. Acest grup include și alte proteine care sunt implicate în mecanismele de semnalizare intercelulară. Studiul imunoglobulinelor a fost realizat datorită enzimelor papaină și pepsină. Sub acțiunea papainei, molecula IgG se rupe în două fragmente Fab și un fragment Fc prin ruperea primelor două legături disulfură. Sub acțiunea pepsinei, se obține un fragment Fab și un fragment Fc. Astfel, s-a constatat că fragmentul Fab conține întregul lanț ușor, precum și variabila și primul domeniu constant al lanțului greu, iar fragmentul Fc conține domeniile constante ale lanțului greu.
Paratop (regiunea anticorpilor care leagă antigenul)
Fiecare monomer care alcătuiește lanțul imunoglobulinei are doi paratopi. Din acest motiv, se numește bivalent. Uneori, monemerii pot fi, de asemenea, monovalenți atunci când funcționează un singur site de legare a antigenului. Paratopa este o fisură cu o formă și o compoziție strict specifice.
- Rezistența respiratorie Fiziologie
- Fiziologia hematopoiezei
- Compoziția gazelor din aer, plămâni și sânge Fiziologie
- Spermatogeneza Fiziologie
- Faimoasa Catedrală Sagrada Familia a amenințat cu prăbușirea din cauza construcției unui tunel feroviar -
