Boala pulmonară obstructivă cronică (BPOC) și apneea obstructivă a somnului (OSA) sunt printre cele mai frecvente boli. Marea lor semnificație socială se datorează mortalității lor ridicate, frecvenței spitalizărilor, calității vieții afectate și pierderii capacității de muncă. Prezența atât a BPOC, cât și a OSA la un pacient este definită ca „sindrom de suprapunere” (OS). Semnificația medicală și socială a acestui sindrom este determinată de dezvoltarea hipoxemiei nocturne severe și a patologiei cardiovasculare severe, care agravează prognosticul și necesită un comportament agresiv.
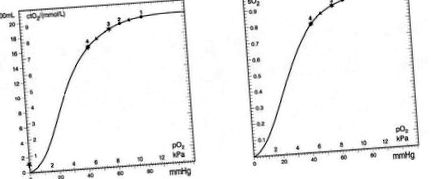
Scăderea fiziologică a presiunii parțiale a oxigenului (PaO2) în timpul somnului la persoanele sănătoase nu duce la desaturare semnificativă. Acest lucru se datorează caracterului de platou al curbei de disociere a hemoglobinei în partea superioară (Fig. 1). Acest curs caracteristic al curbei determină prezența unei rezerve arteriale semnificative de oxigen, care protejează indivizii sănătoși de desaturarea nocturnă semnificativă. Orice scădere a PaO2 (hipoxie) reduce această rezervă și este o condiție prealabilă pentru o apariție mai pronunțată și mai frecventă a desaturării. .
FIG. 1. Mărimea etapei de desaturare (1 → 2 și 3 → 4) la diferite valori inițiale ale PO2 și scăderea PO2 cu 2 kPa.
Definiția OS ca sindrom separat și nu doar prezența simultană a 2 boli se datorează suprapunerii dintre OSA și BPOC și potențării reciproce a efectelor în mai multe direcții:
- Mecanisme corelate pentru apariția unei boli în prezența alteia;
- Suprapunerea în mecanismele fiziopatologice majore (hipoxie, inflamație, stres oxidativ);
- Suprapunerea complicațiilor clinice ale sistemului cardiovascular, care sunt principalele cauze ale morbidității și mortalității ridicate.
Mecanisme pentru apariția unei boli în prezența alteia
Incidența GMS la pacienții cu BPOC este aproximativ aceeași ca la populația generală 12. La pacienții cu BPOC, există atât factori care potențează apariția OSA, cât și cei care previn apariția acestuia. Printre primele se numără redistribuirea rostrală a fluidelor în poziție culcat, fumatul și aportul de corticosteroizi (CS). Redistribuția rostrală a lichidului este deosebit de caracteristică pacienților cu cor pulmonale și duce la umflarea crescută a țesuturilor tractului respirator superior (GAD). Fumatul duce la inflamația cronică a PIB, iar aportul de CS este asociat cu obezitatea abdominală 12 .
Pe de altă parte, pacienții cu BPOC avansată au de obicei un indice de masă corporală scăzut (IMC), care este un factor de protecție pentru GMS 9. În plus, pacienții cu BPOC au o durată redusă de somn REM atunci când manifestările GMS sunt cele mai pronunțate 13. Această tulburare în structura somnului are un anumit caracter adaptativ în hipneemia nocturnă în apnee și non-apnee în BPOC, care sunt cele mai pronunțate în faza REM 12. Scăderea semnalului respirator și sensibilitatea scăzută a centrului respirator la CO2 și O2 și „oprirea” mușchilor respiratori intercostali și accesori în timpul somnului REM, în combinație cu motilitatea diafragmatică redusă în hiperinflație, definesc hipoxentilarea alveolară ca mecanism principal. La pacienți cu BPOC 12. Acest lucru explică, de asemenea, datele privind corelația dintre hiperinflația dinamică (IC/TLC) și eficiența somnului, independent de indicele de apnee-hipnoză 14. Există, de asemenea, o ușoară scădere a capacității reziduale funcționale în timpul somnului, ceea ce poate exacerba și mai mult nepotrivirea ventilației/perfuziei la pacienții cu BPOC 12. Medicamentele precum teofilina au un efect benefic asupra AGA 15 .
Incidența BPOC la pacienții cu GMS este de aproximativ 10-20% și corespunde incidenței bolii în populația generală pentru o anumită grupă de vârstă 12. Nu se cunosc date despre efectul AGA asupra funcției pulmonare. Cu toate acestea, potrivit unui studiu realizat de Phillips și colab., O noapte de lipsă de somn la pacienții cu BPOC a dus la o scădere cu 6% a valorilor FEV1 dimineața. .
Suprapunerea mecanismelor fiziopatologice (hipoxie, inflamație, stres oxidativ)
Prezența hipoxiei este caracteristică atât a BPOC, cât și a GMS. În formele avansate de BPOC, este hipoxia cronică, însoțită la unii pacienți de hipercapnie, care se agravează în timpul somnului. Acest lucru se datorează semnalului respirator slăbit și rezistenței crescute în PIB, care sunt observate și la persoanele sănătoase, dar în prezența BPOC duc la desaturări nocturne semnificative. Acest fenomen este cel mai pronunțat la pacienții cu hipoxemie diurnă, deoarece aceștia sunt localizați pe partea abruptă a curbei de disociere a oxigenului 12 .
La pacienții cu OSA, există hipoxie intermitentă cu desaturare în timpul apneei și normalizarea parametrilor de oxigen după sfârșitul apneei.
Ambele tipuri de hipoxie (în BPOC și OSA) conduc la activarea diferitelor mecanisme adaptive și fiziopatologice. Hipoxia cronică conduce în principal căile așa-numiților factori induși de hipoxie (HIF), în timp ce hipoxia intermitentă - mecanismele asociate cu factorul de transcripție extrem de important - NF-kB (17). Activarea căilor HIF-1 este prezentă și în GMS, în special în obezitate, dar într-o măsură mai mică. Pe de altă parte, familia NF-kB este activă și la pacienții cu BPOC, în special la nivelul mușchilor, ceea ce explică parțial greutatea corporală redusă, spre deosebire de OSA 18. Efectele menționate sunt mai pronunțate la pacienții cu sindrom de suprapunere, din cauza hipoxiei mai pronunțate și a combinației acestor mecanisme.
Hipoxia are ca rezultat creșterea producției de TNF-a și IL-8 atât la pacienții cu BPOC, cât și la cei cu OMG. Prin urmare, nivelurile acestor markeri inflamatori ar trebui să fie deosebit de ridicate în SO, dar astfel de studii lipsesc. Alte citokine inflamatorii, cum ar fi IL-6 și CRP, sunt, de asemenea, crescute în BPOC. Există date contradictorii privind nivelurile IL-6 în GMS, în timp ce creșterea CRP este atribuită obezității la acești pacienți, mai degrabă decât bolii de bază. .
Stresul oxidativ este prezent în BPOC și GMS și este asociat cu niveluri ridicate de specii de oxigen puternic reactive 20.21. În BPOC, acestea sunt produsul leucocitelor circulante intrapulmonare și sistemice, în special în timpul exacerbărilor 20. În GMS, există, de asemenea, o producție crescută de radicali de oxigen din leucocite circulante, precum și peroxidarea lipidelor. La acești pacienți, oxigenarea intermitentă după fiecare apnee seamănă cu leziunea reperfuziei și ar trebui luată în considerare. .
În ciuda prezenței inflamației sistemice și a activării mecanismelor hipoxice atât în BPOC cât și în OSA, nu există studii specifice privind posibila interacțiune a acestor factori la pacienții cu OS.
Complicațiile sistemului cardiovascular
Hipoxia și răspunsul inflamator sistemic joacă un rol principal în fiziopatologia leziunilor cardiovasculare din OS (Fig. 2). Peroxidarea lipidelor, citokinele inflamatorii (IL-1, Il-6, TNF-α etc.) și radicalii de oxigen sunt câțiva dintre factorii care duc la disfuncția endotelială. Fumatul, care este principalul factor etiologic în BPOC, contribuie, de asemenea, în acest sens. Aceste procese îmbunătățesc expresia diferitelor molecule de aderență pe suprafața endotelială și atașarea ulterioară a leucocitelor. Monocitele subendoteliale sunt transformate în macrofage, care sunt fagocitate de particule LDL oxidate și transformate în celule de spumă. Acestea din urmă sunt active funcțional și secretă multe citokine, care duc în cele din urmă la colagenizare și vascularizare a plăcii, făcând-o ireversibilă. Hipoxia joacă un rol important în vascularizația plăcii prin HIF-1. Răspunsul inflamator local duce și la hipoxie locală, prin creșterea nevoilor metabolice.
FIG. 2. Lanț patogenetic între sindromul Suprapunere și bolile cardiovasculare.
Complicațiile cardiovasculare sunt extrem de frecvente la pacienții cu BPOC și sunt principala cauză de deces la aceștia22. Există o relație directă între scăderea indicelui Tifno (FEV1/FVC%), mortalitatea și morbiditatea cardiovasculară și BPOC 12. În plus față de hipoxie, stresul oxidativ și inflamația sistemică, activitatea elastolitică crescută și supraactivarea simpatică joacă un rol în complicațiile cardiovasculare în BPOC 12. Dovezi pentru acesta din urmă în BPOC se găsesc și în prezența unui indice cronotropic redus la acești pacienți 23. În plus față de ateroscleroza accelerată, există un IMC, vârsta și asocierea independentă de fumat a BPOC cu insuficiență cardiacă cronică (CHF) și aritmii. .
Hipoxia, stresul oxidativ, inflamația sistemică, creșterea tonusului simpatic și parasimpatic scăzut, rezistența la insulină și perioadele recurente de presiune intratoracică negativă în timpul apneei sunt mecanismele fiziopatologice ale afectării cardiovasculare la pacienții cu OS. GMS este asociat în mod independent cu boli coronariene, CHF, aritmii, hipertensiune și SMB. 12 Datele din studiul Wisconsin 24 arată o creștere a mortalității și morbidității cardiovasculare în SMG, scăzând odată cu utilizarea CPAP.
Pe baza mecanismelor fiziopatologice generale și complementare ale afectării cardiovasculare în BPOC și SMG, poate fi de așteptat cel puțin un efect cumulativ la pacienții cu OS. Există dovezi ale hipertensiunii pulmonare 25 mai pronunțate și a mortalității mai mari la pacienții cu OS comparativ cu pacienții cu BPOC 25. Există o incidență crescută a spitalizărilor și un risc crescut de deces la pacienții cu OS comparativ cu cei cu BPOC, dar fără OSA datorită frecvenței crescute a exacerbărilor 25. În studiul lui Marin și colab. Terapia OSA în OS CPAP îmbunătățește supraviețuirea și reduce internările la niveluri comparabile cu cele la pacienții cu BPOC, dar fără OSA 25. Date similare sunt publicate de Machado și colab. 26 .
Datele indicate cu privire la morbiditatea și mortalitatea ridicată în sistemul de operare necesită căutarea activă a „simptomelor majore” ale OSA (pauze de apnee în somn, sforăit zgomotos, somnolență în timpul zilei) la orice pacient cu BPOC, mai ales dacă este supraponderal. Urmărirea respirației induse de somn sau chiar saturația nocturnă poate fi cheia diagnostic pentru acei pacienți cu BPOC care au policitemie sau cor pulmonale cu obstrucție relativ ușoară a fluxului de aer. După cum sa remarcat de A. Chaouat și colab., La valori date FEV1 și FEV1/VC%, PaO2 este mai mic, PaCO2 este mai mare și hipertensiunea pulmonară este mai frecventă în sindromul de suprapunere decât în BPOC tipic. 27 Fiecare pacient este indicat pentru polisomnografie dacă cor pulmonale și policitemie sunt observate în PaO2> 60 mm Hg 2. Prezența unei dureri de cap dimineața după oxigenoterapie pe timp de noapte necesită și polisomnografie 2 .
Experiența noastră arată că curba de disociere a oxihemoglobinei (ODC) poate fi utilizată și ca agent de prognostic pentru desaturarea nocturnă non-calcaroasă la pacienții cu BPOC 28. Scăderea PaO2 în BPOC este adesea combinată cu hipercapnie și acidoză, precum și cu modificări specifice ale moleculei de hemoglobină (creștere în 2,3-DPG și P50). Curba de disociere a oxihemoglobinei se deplasează spre dreapta, iar parametrii oxigenului cad în partea cea mai abruptă, ceea ce este o condiție prealabilă pentru o desaturare nocturnă semnificativă (Fig. 1). Din acest motiv, așa-numiții „coeficienți de capacitate”, care sunt o măsură a pantei în diferitele părți ale ODC, sunt, de asemenea, un mijloc de a prezice desaturările nocturne 29 .
Tratamentul hipoxemiei nocturne non-apneice și apneei în BPOC
Pacienții a căror saturație bazală rămâne sub 88% în cea mai mare parte a nopții sau care au o inimă pulmonară cronică fără constelația funcțională necesară sunt supuși terapiei cu oxigen 2, 30. American Thoracic Association recomandă creșterea fluxului de oxigen pe timp de noapte cu aproximativ 1 L/min peste zi, pentru a depăși efectul suplimentar al desaturării nocturne 30. Când pacienții nu au OSA, oxigenoterapia pe timp de noapte corectează hipoxemia nocturnă fără a duce la o creștere semnificativă a PaCO2. Până în prezent, doar hipoxemie zilnică semnificativă (PaO2 3 .
Terapeutic, combinația BPOC cu GMS complică tratamentul. Studiile au arătat că oxigenoterapia izolată în prezența apneei obstructive de somn elimină rareori hipoxemia, ducând deseori la retenție semnificativă de CO2 și cefalee dimineața 31. În sindromul de suprapunere, administrarea presiunii nazale pozitive constante a căilor respiratorii (nCPAP) este medicamentul de elecție. În prezența obstrucției severe a fluxului de aer și a necesității unor presiuni terapeutice ridicate pentru a depăși pauzele de apnee, terapia cu nCPAP poate duce la hipercapnie semnificativă. În aceste cazuri, utilizarea ventilației neinvazive pe două niveluri (BiPAP), care facilitează expirarea și eliminarea CO2, este deosebit de adecvată.
- Modificări ale indicelui BODE după kinetoterapie aplicată la pacienții cu boală pulmonară obstructivă cronică
- A cincea boală - Interesant - Viață sănătoasă - Doctor online - site pentru sănătate
- Terapie naturală pentru hipertensiunea pulmonară Tratamentul berberinei Belcho Hristov - Suplimente dietetice de fitness
- Petar Dimkov despre boala Burger
- O boală periculoasă ne amenință dacă bem sifon