Glicogeneza este o tulburare metabolică moștenită a metabolismului glicogenului, în perioada postprandială crește nivelul glicemiei și se suprimă producția de glucoză endogenă. În condiții aerobe, piruvatul este transformat în acetil coenzima A (acetil-CoA), care intră în ciclul acidului citric, ai cărui produse sunt apă, dioxid de carbon și adenozin trifosfat (ATP) sau este utilizat pentru sinteza acizilor grași. În schimb, în condiții anaerobe, piruvatul este transformat în lactat, care este un combustibil alternativ important în timpul episoadelor de hipoglicemie. Diferiti hormoni, inclusiv insulina, glucagonul, cortizolul si altii regleaza relatia dintre glicoliza, gluconeogeneza si sinteza glicogenului.
Deși este dificil de estimat cu precizie, pe baza mai multor studii, frecvența generală a glicogenoză este de aproximativ 1 caz la 20.000-43.000 nașteri vii. Acestea sunt clasificate pe baza deficitului enzimatic și a țesutului afectat. Tulburările de descompunere a glicogenului pot afecta în principal ficatul, mușchii și/sau ambii. Episoadele de hipoglicemie și hepatomegalie sunt principalele constatări în toate glicogenozele hepatice, dar eterogenitatea prezentării lor este semnificativă.
Glicogeneza se datorează a două tipuri de factori: genetici și dobândiți. Glicogeneza genetică este cauzată de orice eroare metabolică congenitală (enzime cu defecte genetice) implicată în aceste procese. În glicogenoză dobândită, cauza este intoxicația cu alcaloidul castanospermină.
Există mai multe tipuri de glicogenoză:
- Glicogenoză tip I/Morbus von Gierke /
- Glicogenoză tip II/Morbus Pompe /
- Glicogenoză tip III/Morbus Cori, limită dextrinoasă /
- Glicogenoză tip IV - boala Andersen
- Glicogenoză tip V/Morbus Mac - Ardle /
- Glicogenoză tip VI/Morbus Hers /
- Glicogenoză tip VII
- Glicogenoză VIII
Glicogeneza de tip I este o boală autozomală recesivă moștenită. În acest tip, cunoscut și ca boală hepato-renală, există un deficit de glucoză-6-fosfatază. În stare normală a corpului, 60% din glucoza care este absorbită în intestin este transferată în ficat, unde este stocată ca glicogen. Glicogen-6-fosfatul obținut prin glicogenoliză este degradat din glucoză-6-fosfatază în glucoză. Lipsa enzimei duce la acumularea excesivă de glicogen normal în ficat și mai puțin în rinichi. Nivelul glicemiei rămâne scăzut. Odată cu includerea mecanismelor compensatorii ca în glicoliza anaerobă, lactatul este crescut și se observă hiperlipoproteinemia și cetoacidoza. Boala se manifestă în copilărie. Tabloul clinic este exprimat prin scăderea în greutate, vărsături și crizele cetonice.
În scopuri practice, în funcție de activitatea enzimei și de prezența mutațiilor în genele G6Pase și T, glicoza de tip I poate fi împărțită în două forme principale. Tipul 1a a demonstrat o activitate G6Pase insuficientă în țesutul hepatic proaspăt și înghețat. Tipul Ib a demonstrat activitate normală G6Pase în probele de țesut înghețat și a scăzut activitatea probei proaspete. G6Pase se găsește în principal în ficat, rinichi și intestin pentru a susține glicogenoliza și gluconeogeneza. Datorită activității insuficiente a G6Pazei, G6P nu poate fi transformat în glucoză liberă și este metabolizat în acid lactic sau încorporat în glicogen. Excesul de glicogen care se formează este stocat ca molecule cu o structură normală în citoplasma hepatocitelor, a rinichiului și a celulelor mucoasei intestinale. Depozitarea excesivă de glicogen determină mărirea ficatului și a rinichilor, care domină prezentarea clinică a acestei boli. Modificarea biochimică majoră este hipoglicemia non-ketotică, iar anomaliile biochimice secundare sunt hiperlactatemia, acidoză metabolică, hiperlipidemie și hiperuricemie, care determină decompensare metabolică.
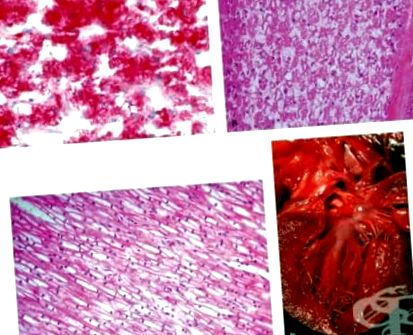
Macroscopic, se observă hepatomegalie severă și renomegalie ca urmare a acumulării unor cantități excesive de glicogen. Consistența lor este densă. Culoarea lor este palidă. Nu s-a observat splenomegalie. Glicogenul se acumulează în citoplasmă și nucleul hepatocitelor și celulelor epiteliale ale tubilor renali. Limitele celulelor sunt bine delimitate, nucleul este situat central, citoplasma este palidă. În unele hepatocite, semne de degenerescență grasă sunt observate în același timp.
Glicogeneza de tip II, cunoscută și sub denumirea de deficit de alfa glucozidază sau boala Pompe, este o prototip de boală lizozomală. Pompe a descris inițial boala în 1932. Îi lipsește enzima lizozomală α-1,4-glicozidază (maltază acidă). Tabloul său clinic diferă în mod clar de alte forme, deoarece este cauzat de o deficiență a enzimei lizozomale, alfa-1,4-glucozidaza, ceea ce duce la o acumulare patologică de glicogen structurat în mod normal în lizozomii majorității țesuturilor. Există trei forme ale bolii: în copilăria timpurie, la nou-născuți și adulți. În vârsta infantilă clasică, principalele semne clinice sunt cardiomiopatia și hipotensiunea musculară (mușchi neted și schelet). În celelalte două forme, implicarea mușchilor scheletici domină prezentarea clinică. Glicogenul normal se acumulează în lizozomii celulelor mușchilor striați și netezi, în ficat, splină, plămâni, pereți vasculari, creier, piele și mai ales în miocard.
Macroscopic, forma cardiacă a acestui tip de glicogenoză este cel mai adesea observată. Inima este hipertrofiată. Greutatea sa crește de 2-3 ori. Consistența sa este moderat densă. Miocardul este palid. Microscopic, cardiomiocitele sunt umflate, luminoase și cu margini puternic delimitate. Glicogenul se acumulează în jurul nucleelor cardiomiocitelor sub formă de vacuole. Glicogenul se acumulează și în cantități mari în mușchii netezi ai tractului digestiv. Acumularea în esofag îngreunează înghițirea. Incluziuni în lizozomii particulelor de glicogen din cardiomiocite, celule neuroganglionare ale creierului și din alte părți.
Glicogeneza de tip III este, de asemenea, cunoscută sub numele de boala Forbes-Cori sau dextrinoza. Este o tulburare autosomală recesivă în care există mutații genetice în AGL care determină un deficit al enzimei de derefracție a glicogenului și stocare limitată de dextrină. Această boală nu are amilo-1,6-glicozidază. Acest lucru duce la scindarea incompletă a glicogenului și la formarea de glicogen defect - limită dextrină. Acesta din urmă se acumulează în ficat, splină și mușchii scheletici.
Tabloul morfologic este similar cu cel al glicogenozei de tip I. Tabloul histologic al ficatului la pacienții cu glicogenoză de tip III se caracterizează prin dizolvarea totală a celulelor hepatice din glicogen și țesut fibros. Procesul fibrotic poate fi caracterizat prin boală periportală minimă sau ciroză micronodulară. Acest lucru nu este de obicei progresiv.
Glicogeneza de tip IV, cunoscută și sub denumirea de amilopectinoză, deficit de enzimă glicogen sau boala Andersen, este o boală rară care are ca rezultat moartea timpurie. În 1956, Andersen a raportat primul pacient cu hepatosplenomegalie progresivă și acumulare de polizaharide anormale. Principalele semne clinice sunt insuficiența hepatică și anomaliile inimii și ale sistemului nervos. Îi lipsește enzima amino-1,4: 1,6 transglicozidază. Datorită acumulării de glicogen anormal insolubil în hepatocite, se induce un proces fibroplastic puternic, care se termină cu ciroza hepatică nodulară mică. Boala apare în copilărie cu hepatosplenomegalie și ascită.
Macroscopic, se observă ciroză hepatică, splenică și limfadenomegalie. Microscopic, glicogenul se acumulează în hepatocite și celule Kupffer ale ficatului, în histiocitele splinei și ganglionilor limfatici. Biopsia hepatică și musculară a arătat hepatocite mărite, PAS-pozitive și incluziuni rezistente la diastază. Histocitele spumante din sistemul reticuloendotelial pot fi observate și în ficat. Fibroza interstițială este, de asemenea, prezentă, se observă agregate fibrilare de material asemănător amilopectinei la microscopul electronic.
Glicogeneza de tip V, cunoscută și sub numele de boala McArdle, afectează mușchii scheletici. Este o tulburare autosomală recesivă în care există un deficit de glicogen fosforilază. McArdle a raportat primul pacient în 1951. Semnele inițiale ale bolii se dezvoltă de obicei la adolescenți sau adulți. Deficitul de fosforilază musculară, care afectează negativ calea glicolitică în mușchiul scheletic, provoacă glicogenoză de tip V. Ca și alte forme, boala McArdle este eterogenă. Boala se manifestă pe parcursul celui de-al douăzecilea an de viață cu crampe musculare dureroase după efort fizic. Mioglobinuria este observată în peste 50% din cazuri. Nivelurile crescute de lactat se găsesc în sângele periferic.
Lipsa fosforilazei duce la acumularea de glicogen normal în mușchiul scheletic din cauza incapacității de a se descompune în acid lactic. Microscopic, există o acumulare sub sarcolema miocitelor de vacuole PAS pozitive. În mioglobinuria, care însoțește adesea boala, este posibil să se observe fascicule de mușchi hialinizate.
Glicogeneza de tip VI, cunoscută și sub numele de boala Hers, aparține grupului hepatic glicogenoză și este o boală eterogenă. Deficitul de fosforilază hepatică sau deficiența altor enzime care formează cascada necesară activării fosforilazei hepatice cauzează boala. În 1959, Hers a descris primii pacienți cu deficit de fosforilază dovedit. Din punct de vedere clinic, seamănă cu tipul I, dar este mult mai ușoară. Microscopic, o cantitate mare de glicogen se acumulează în citoplasma hepatocitelor, combinată cu picături mici de grăsime. Hepatocitele crescute cu glicogen acumulat (adică particule alfa, formă de rozetă) pot fi observate și sunt mai puțin compacte decât în glicogenozele clasice de tip I și III.
Glicogeneza de tip VII, cunoscută și sub numele de boala Tarui, rezultă din deficiența fosfofructokinazei. Enzima se găsește în mușchiul scheletic și eritrocite. Tarui a raportat primii pacienți în 1965. Caracteristicile clinice și de laborator sunt similare cu cele ale glicogenozei de tip V. Polizaharida anormală se acumulează cu morfologia fibrilară în mușchiul scheletic.
Glicogeneza VIII este o boală rară care este moștenită recesiv și este legată de cromozomi. Doar bărbații se îmbolnăvesc. Boala se caracterizează prin hepatomegalie moderată și hipoglicemie. Enzima fosforilazei hepatice B-kinază, care activează în mod normal fosforilaza hepatică, lipsește.
- Tumori benigne ale intestinului subțire Patologie
- Dr. Milena Bozhilova - Diagnosticul de laborator al patologiei cortexului suprarenal
- Distrofia Distrofia calciului - Patologie
- Dietele posibile pentru colita ulcerativă
- Dieta Ducesei Kate pentru o siluetă perfectă - Știri din Burgas