Dr. Vera Karamfilova, prof. Dr. Zdravko Kamenov
Clinica de endocrinologie și boli metabolice, Spitalul Universitar „Alexandrovska”, Sofia
Termenul sindrom metabolic (SM) include obezitate abdominală, rezistență la insulină, dislipidemie și hipertensiune arterială, care sunt asociate cu o serie de alte tulburări, inclusiv afecțiuni protrombotice, inflamație cronică de nivel scăzut, steatoză nealcoolică, boli hepatice și boli hepatice etc. Prevalența SM a crescut exclusiv în ultimii 20 de ani, câștigând proporții epidemice nu numai în țările dezvoltate, ci și în cele în curs de dezvoltare. Majoritatea studiilor arată că SM este asociată cu aproape dublul riscului de boli cardiovasculare (BCV) și o creștere de cinci ori a riscului de a dezvolta diabet zaharat de tip 2 (DM2) [1]. În ciuda existenței unor întrebări încă nerezolvate cu privire la mecanismele fiziopatologice, baza dezvoltării sale este obezitatea abdominală (viscerală, androidă) și rezistența la insulină cu componentele sale specifice. Schimbarea stilului de viață și pierderea în greutate sunt în centrul tratamentului și prevenirii SM și a componentelor sale.
SM este un complex de factori de risc specifici strâns legați pentru GCC și DM2. Unul dintre primele rapoarte despre o asociere între hipertensiune, hiperglicemie și gută datează de la începutul secolului al XX-lea și a fost descris de Kylin. În 1947, Vague a descris legătura dintre obezitatea abdominală, dezvoltarea diabetului și bolile cardiovasculare. În 1988, Reaven a introdus termenul „Sindrom X” ca o combinație de rezistență la insulină, hiperglicemie, hipertensiune, HDL-colesterol scăzut (HDL-C) și trigliceride crescute (TG).
Prima definiție a SM a fost publicată în 1999 de OMS, conform căreia sindromul este definit ca toleranță la glucoză afectată (NGT) sau diabet și/sau rezistență la insulină (IR), împreună cu doi sau mai mulți dintre următorii factori: sânge crescut (TA)) ≥140/90 mmHg, TG crescut ≥1,7 mmol/l și/sau HDL-C scăzut ≤1,0 mmol/l la bărbați și ≤1,3 mmol/l la femei, obezitate centrală (raportul talie/șold> 0,9 pentru bărbați și> 0,85 pentru femei) și/sau indicele de masă corporală (IMC)> 30 kg/m2, microalbuminurie ≥20 g/min. sau raportul dintre albumină și creatinină ≥30 mg/g [2] .
În 2005, Federația Internațională a Diabetului (IDF) a publicat o nouă definiție a sindromului metabolic [3], bazată pe un consens interdisciplinar larg, care include obezitatea centrală determinată de circumferința taliei cu unele valori etnice specifice - pentru rasa europeană ≥ 94 cm la bărbați și ≥80 cm la femei, plus două dintre următoarele caracteristici:
Niveluri crescute de TG ≥1,7 mmol/l sau tratament specific pentru această tulburare.
HDL-C scăzut ≤1,03 mmol/l la bărbați și ≤1,29 mmol/l la femei sau tratament specific pentru această tulburare.
Tensiune arterială crescută ≥130/85 mmHg sau tratament pentru hipertensiune.
Hiperglicemie de post ≥5,6 mmol/l sau DM2 diagnosticat anterior. Atunci când astfel de valori sunt stabilite pe stomacul gol, se recomandă efectuarea OGTT, iar acest lucru nu este obligatoriu pentru confirmarea sindromului.
Principalii factori exogeni asociați cu obezitatea viscerală sunt stilul de viață sedentar și aportul crescut de energie cu alimentele, care interacționează cu o anumită predispoziție genetică responsabilă atât pentru obezitate, cât și pentru rezistența la insulină și inflamația cronică.
SM este asociată cu un risc ridicat de boli coronariene (CHD) și DM2, care în sine este considerat echivalentul aterosclerozei coronare. Studiul prospectiv al diabetului din Marea Britanie (UKPDS) a arătat că complicațiile vasculare ale diabetului zaharat încep înainte de diagnostic. Mai mult, mai mult de jumătate dintre pacienți au una sau mai multe complicații vasculare legate de boală (neuropatie periferică și boală vasculară - 10%, retinopatie - 20-40%) [4]. Dezvoltarea acestor complicații este legată de vârsta disglicemiei, ceea ce înseamnă că DM2 apare cu aproximativ 10 ani înainte de diagnosticul său clinic. Acest lucru arată cât de important este să se evalueze factorii de risc incluși în SM, să se efectueze programe de screening la pacienții cu risc, studii active ale anomaliilor metabolice pentru prevenirea timpurie a CKD și DM2.
Obezitatea viscerală este definită ca un centru al SM și un factor major în rezistența la insulină - o varietate de defecte ale receptorilor și post-receptorilor care interferează cu funcția normală a insulinei și necesită un răspuns compensator la hiperinsulinemie. La nivel mondial, obezitatea a devenit o pandemie, o cauză majoră a creșterii alarmante a SM, BCV și AD2 [5]. Tulburările carbohidraților se bazează pe rezistența la insulină, care se corelează puternic atât cu tulburările metabolice, cât și cu disfuncția endotelială, inflamația sistemică cronică, fibrinoliza redusă, dislipidemia și AH. Rezistența la insulină se realizează la diferite niveluri.
Rezistența la insulină în țesutul adipos
Rezistența la insulină în țesutul adipos joacă un rol important în patogeneza SM. În condiții de rezistență la insulină și obezitate viscerală, a crescut lipoliza (cu eliberarea acizilor grași liberi (FFA) din TG stocat în țesutul adipos [6,7]), care, la rândul său, îmbunătățește rezistența la insulină, adipocitele viscerale fiind semnificativ Pe măsură ce fluxul sanguin venos din țesutul adipos visceral curge direct în sistemul portal, acesta este asociat cu intrarea imediată a SMC în ficat, provocând rezistență la insulină acolo, așa-numita „teorie portal” [7, 8 ] .
Rezistența la insulină în ficat
Ficatul joacă un rol major în metabolismul substratului. Creșterea influxului de CMC perturbă acțiunea insulinei, crește producția hepatică de glucoză, sinteza proinflamatorie de citokine și modifică semnificativ metabolismul lipoproteinelor. În condiții normale, insulina crește expresia genică a unui număr de enzime implicate în sinteza TG, care este asociată cu o reducere a VLDL, TG și a apolipoproteinei B (apo B), inhibând lipoliza în țesutul adipos [9] .
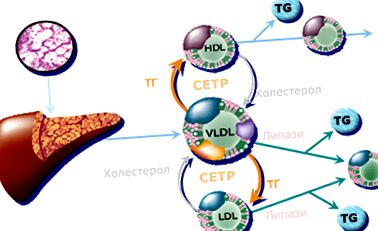
În schimb, în condiții de rezistență la insulină, crește influxul de CMC în ficat, crește și sinteza și depozitarea TG, iar cantitățile crescute de TG sunt secretate sub formă de VLDL [10]. Astfel, dislipidemia asociată cu rezistența la insulină este o consecință directă a VLDL hepatic crescut, ceea ce explică și lipsa creșterii LDL-C în SM. Hipertrigliceridemia în SM este asociată cu scăderea nivelului HDL-C. Acest lucru este parțial legat de transferul esterilor de colesterol din lipoproteinele bogate în TG în HDL-C, un proces care este catalizat de proteina de transfer a esterilor de colesterol (CETP) [11,12]. Acest lucru are ca rezultat generarea de HDL-C mici, bogate în TG, care sunt un substrat adecvat pentru lipaza hepatică, în timp ce suferă un clearance renal rapid. În condiții de hipertrigliceridemie, tipice MS și rezistența la insulină, există prezența particulelor LDL-C mici, dense, cu proprietăți aterogene puternice dovedite [13] (Fig. 1).
Figura 1: Rolul CETP în dislipidemia în SM (Bays H. Expert Rev Cardiovasc Ther 2004; 2: 89-105).
SM este asociată cu niveluri crescute și activitate a unui număr de molecule proinflamatorii, inclusiv proteina C-reactivă (CRP), TNFα, rezistină, IL-6, IL-18, PAI-1 și altele. [14]. Pe de altă parte, există o scădere a adiponectinei, care are un efect protector. CRP este unul dintre principalii markeri ai inflamației, care este asociată cu creșterea circumferinței taliei, rezistenței la insulină, IMC și hiperglicemie. Nivelurile crescute ale CRP sunt considerate un predictor independent al rezultatului advers în SM [15] .
Steatoza hepatică este asociată nu numai cu rezistența la insulină, ci și cu SM. Este rezultatul depozitării excesive a acizilor grași sub formă de TG și a dezvoltării steatozei nealcoolice și steatohepatitei (NASH) [16]. Studiile din acest domeniu au demonstrat rolul rezistenței la insulină, stresul oxidativ, peroxidarea lipidelor și citokinele în dezvoltarea NASH. 2-3% din populația din Europa și Statele Unite sunt afectate de această problemă și se crede că, având în vedere epidemia de obezitate și SM, această boală poate provoca dezvoltarea cirozei hepatice în stadiu final și a carcinomului hepatocelular [20] . .
Hipertensiune arterială și rezistență la insulină
Relația dintre AH și rezistența la insulină este bine cunoscută și se bazează pe diverse mecanisme. Este important de menționat că insulina este un vasodilatator atunci când este administrată intravenos la persoanele cu greutate normală, cu efect secundar asupra reabsorbției de sodiu în rinichi [16]. Cu toate acestea, în prezența rezistenței la insulină, se pierde efectul vasodilatator al insulinei, dar efectul renal asupra reabsorbției de sodiu rămâne. La rândul său, insulina activează sistemul nervos simpatic, cu studii care arată o ușoară creștere a tensiunii arteriale [17]. Pe de altă parte, țesutul adipos este o sursă de angiotensinogen, ceea ce duce la hiperaldosteronism și AH [18]. Leptina și rezistina secretate din țesutul adipos sunt, de asemenea, implicate în mecanismele patogenetice ale AH în SM [19] .
Abordarea tratamentului în SM
Recomandările pentru tratamentul SM includ un răspuns cuprinzător la toți factorii de risc pentru a preveni BCV și DM2. Acestea se concentrează pe modificările stilului de viață, inclusiv dieta și activitatea fizică, farmacoterapia și chirurgia bariatrică.
- Noi linii directoare pentru diagnosticul și tratamentul sindromului ovarului polichistic Stiri medicale
- Echilibru metabolic, bucurie și bucurie BG-Mamma
- Sindromul ovarului polichistic; In Vitro Clinic Malinov - In Vitro
- Sindromul ovarului polichistic Dr. Maria Georgieva
- Sindromul metabolic - Dr. Tsvetanka Terzieva