Dr. Nikolina Radulova
17 DCC, Sofia
Epigenetica din cuvântul grecesc „epi” (deasupra, afară) este studiul schimbării. În expresia genică sau fenotipul celular cauzat de mecanisme care nu afectează secvența ADN. Reglarea și exprimarea genelor este rezultatul proceselor de metilare a ADN-ului și modificarea histonelor. Structura primară a ADN-ului este păstrată.
În condiții de hiperlipidemie, CD34 + poate fi modificat epigenetic la celulele inflamatorii, modificându-le astfel pentru a se diferenția în linii celulare dăunătoare.
Hiperglicemia, prin efectul său profund asupra semnalelor și căilor multiple, este un factor cheie în transcriere. Se consideră că defectele funcției celulelor pancreatice și rezistența la insulină tisulară rezultă din producția scăzută de ATP și fosforilarea oxidativă redusă. O creștere aproximativ dublă a metilării ADN a promotorului PPARGC1A a fost observată la pacienții cu diabet zaharat, rezultând în suprimarea expresiei genice. Gena PPARGC1A reglează genele implicate în metabolismul energetic. Testele cu celule ale insulelor umane la diabetici, comparativ cu non-diabetici, arată că cu cât este exprimată mai mult această genă, cu atât insulina este secretată mai mult de insuline. Pacienții cu diabet zaharat au PPARGC1A mai puțin exprimat și mai puțină secreție de insulină. Metilarea ADN-ului este considerată a fi un mecanism prin care PPARGC1A este respins.
Un studiu foarte interesant arată rolul activității fizice și influența asupra reglării genei PPARGC1A. La subiecții plasați în repaus prelungit la pat timp de 10 zile, s-a observat o creștere semnificativă a metilării ADN a genei și o scădere a expresiei ARNm. Un alt factor de risc este greutatea redusă la naștere (LBW) într-un studiu care arată că există o metilare crescută a ADN-ului în celulele musculare ale acestor pacienți.
Atenuarea epigenetică prin metilarea ADN a promotorului genei PDX1, care produce un factor cheie de transcripție care reglează diferențierea celulei beta și expresia genei insulinei, poate provoca simptome caracteristice diabetului de tip 1 și diabetului de tip 2. La om, această proteină este codificată de Gena PDX1, cunoscută anterior ca IPF1. La pancreasul matur, expresia PDX1 pare a fi necesară pentru supraviețuirea celulelor beta și este importantă în medierea efectului insulinei asupra morții celulare beta programate apoptotic. Concentrațiile scăzute de insulină protejează celula beta de apoptoză, dar nu și în celulele în care expresia PDX1 este inhibată. Experimentele au arătat că o scădere a expresiei sale duce la producerea mai multor glucagon, ceea ce sugerează că are o influență asupra inhibării conversiei celulei beta într-o celulă alfa.
Epigenetica poate juca un rol într-o gamă largă de complicații vasculare în diabet. Variațiile epigenetice asociate cu diabetul pot modifica structura cromatinei, precum și expresia genelor, indiferent de controlul glicemic modificat. Aceste mecanisme epigenetice rămân persistente și nu se schimbă odată cu modificarea dietei. Cele mai frecvente complicații ale diabetului sunt vasculare. În cultivarea celulelor endoteliale cu conținut ridicat de glucoză, se observă o creștere susținută a expresiei noilor gene extracelulare și profibrotice și o creștere constantă a stresului oxidativ după normalizarea ulterioară a glucozei. Aceste studii indică faptul că efectele adverse ale expunerii anterioare la hiperglicemie au efecte pe termen lung asupra organelor țintă. Epigenezia este considerată a fi principalul motiv pentru persistența acestor puncte simptomatice.
Hiperglicemia duce, de asemenea, la reglarea unei gene cunoscută sub numele de UNC13B. Centrul Național pentru Informații despre Biotehnologie din Statele Unite a constatat o creștere a metilării unor situri CPG importante din genă. UNC13B produce o proteină cu un domeniu de legare a diacilglicerolului (DAG).
Tratamentul posibil al complicațiilor vasculare în diabet există în gena SIRT1. Expresia sa de resveratrol poate îmbunătăți rezistența la insulină. S-a demonstrat că enzima SIRT1 modulează metabolismul energetic și inflamația.
Memoria metabolică este un fenomen al efectelor vasculare diabetice care continuă după normalizarea glucozei la pacienții cu diabet zaharat.
Este, de asemenea, cunoscut sub numele de „memorie hiperglicemică” sau „efect ereditar” și se referă la efectele pe termen lung ale nivelurilor de zahăr din sânge, controlate prost pe termen lung.
În 2014, un raport al American Diabetes Association al unui studiu numit EDIC (Epidemiology of Diabetes Interventions and Complications) a arătat că menținerea unui control bun al zahărului din sânge timp de câțiva ani ar putea duce la o reducere a bolilor cardiovasculare la diabetici. De fapt, potrivit studiului, pentru fiecare reducere de 1% a nivelurilor A1C, se poate aștepta o reducere corespunzătoare cu 20% a riscului cardiovascular.
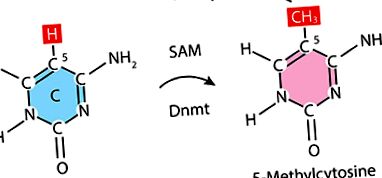
Hiperglicemia pare să fie amintită în organe precum rinichii, ochii și inima. Dovada acestui fapt este schimbarea progresiei nefropatiei, retinopatiei și neuropatiei periferice la pacienții tratați intens și la cei cu control slab. Memoria metabolică poate fi reglată de epigenetică. Stresul oxidativ poate juca, de asemenea, un rol important în conservarea memoriei metabolice prin modificarea sau deteriorarea lipidelor esențiale, proteinelor și/sau ADN-ului. Studii recente au arătat că la pacienții cu diabet zaharat există o creștere a histonei metiltransferazelor și o scădere a H3K9ME3, ducând la inhibarea cromatinei. În diabetul zaharat, studiile au arătat, de asemenea, rolul homocisteinei, care este un intermediar responsabil pentru menținerea reacțiilor de metilare în procesele metabolice critice. Poate fi re-metilat pentru a forma metionină, încorporat în calea cisteină sintetică BIF sau eliberat în mediul extracelular. Metionina afectează direct S-adenosilmetionina (SAM). SAM este o substanță care furnizează grupări metil pentru metilarea ADN-ului.
În ultimele zile, cercetătorii de la Institutul de Genetică din Michigan au raportat posibilitățile oferite de metodele utilizate pentru a adnota experimental variante necodificate în molecula ADN, pentru a nominaliza variante cauzale și pentru a le lega de fiziopatologia diabetului. Capacitățile de profilare a cromatinei, secvențierea în paralel în masă, teste de mare viteză și tehnologiile de editare a genei CRISPR iau în considerare semnificația contextuală atât genetic (ca o secvență concomitentă de ADN), cât și în mediu (ca stare celulară sau expunere la mediu). Rezistența la insulină include și controlul epigenetic prin metilarea promotorului a genei aTFAM a factorului de transcripție mitocondrială, care este esențială pentru menținerea ADN-ului mitocondrial și se leagă la IR (rezistența la insulină) la adolescenți, potrivit unui studiu din 2011.
Datorită posibilei reversibilități a modificărilor epigenetice, acest studiu demonstrează potențialul stilului de viață sau al intervențiilor terapeutice în rezistența la insulină.
Studiile arată o legătură între anumite tipuri de bacterii și grăsimea corporală și, ca rezultat, un răspuns inflamator crescut, care la rândul său contribuie la disfuncția metabolică asociată diabetului de tip II.
Modificările dietei duc la metilarea diferită a genelor. Prin schimbarea dietei, procesele se desfășoară la nivel molecular, ceea ce duce la adăugarea de grupări metil la molecula ADN, fără a modifica codul din interior, dar schimbând expresia genei, manifestându-se astfel sau nu o trăsătură. În timpul diviziunii celulare, noile grupări metil se atașează la ADN-ul nou sintetizat. Sursa acestor grupuri este mâncarea. Moleculele care donează grupări metil în celulele noastre sunt metionina, betaina și colina.
Alimentele bogate în acid folic (cum ar fi legumele cu frunze, citricele și căpșunile) alimentează organismul cu grupări metil, care sunt transportate prin molecule de transport precum vitaminele. B12 și zinc. Peștele, carnea, laptele și ouăle conțin vitamine. B12.
Compoziția fiecărui aliment are un efect direct asupra producției de semnale chimice din creier prin producția de neurotransmițători.
Acestea afectează starea de spirit, somnul, memoria, concentrarea, respirația.
De exemplu, epuizarea norepinefrinei duce la oboseală cronică, tulburări de memorie, depresie. Este cunoscut rolul altor neurotransmițători (cum ar fi serotonina, dopamina, epinefrina), precum și aminoacizii GABA și glicină, glutamat, aspartat, precum și neuropeptidele și purinele (cum ar fi adenozina și ATP).
Cele mai recente rezultate, publicate acum o lună de un studiu de cohortă realizat de un centru de cercetare danez privind nivelurile de enterolactonă plasmatică la pacienții cu diabet zaharat de tip 2, au constatat că concentrațiile mai mari erau asociate cu o mortalitate mai mică și un prognostic mai bun. Enterolactona este un metabolit fitoestrogen produs de microbioza intestinală după ingestia alimentelor bogate în lignani. Acestea sunt secară integrală împotriva grâului rafinat (care are un conținut scăzut de lignan), semințe de in (bogate în acizi grași omega). De asemenea, surse bune de lignani sunt fructele bogate în fibre, legumele, leguminoasele și nucile, semințele, în cantități mai mici de cafea, ceai, vin și bere, al căror consum duce la un control glicemic îmbunătățit și la lipide în sângele persoanelor cu diabet. Se acordă atenție și calităților utile ale alimentelor fermentate. Metabolismul lignanilor în enterolignani este influențat de mai mulți factori, inclusiv fumatul, obezitatea, utilizarea antibioticelor, microbioza intestinală.
Conceptul de „microflora intestinală” este acum învechit și, ca rezultat al cercetărilor și muncii efectuate de un număr mare de oameni de știință în 2001, Institutul SUA de Nutriție a introdus conceptul de „microbiom”, ca un concept modern extins de microflora și o combinație de nu numai microbi, ci și gene microbiene. Microbiom - acesta este un fel de ecosistem, supus modificărilor sub influența multor factori, inclusiv dieta (ca mod de a mânca) și bolile intestinale.
Sute de trilioane de bacterii trăiesc în corpul uman. Potrivit cercetărilor oamenilor de știință, macrobiomul unui adult este de la jumătate la 3 kg. Este considerat ca un organ separat, care conține de 10 ori mai multe celule decât celulele corpului și de treizeci de ori mai multe gene decât cele ale omului.
Memoria lor genetică afectează memoria genetică umană.
Potrivit unui raport din 2012 al Institutului Național de Sănătate al SUA privind proiectul microbiomului uman, microbiomul unei persoane diferă drastic de cel al unei alte persoane și, de asemenea, se poate schimba rapid în timp. Este, de asemenea, considerat ca un fel de cod de bare. Primii microbi intră în organismul nou-născut în canalul nașterii și apoi societatea bacteriană nu ne părăsește pentru tot restul vieții. Numai compoziția sa se schimbă.
Coexistența cu aceste bacterii are un impact imens asupra stării sănătății noastre. Un număr din ce în ce mai mare de studii arată importanța sistemului imunitar. Intoleranța alimentară trebuie distinsă de alergii. În alergii există o creștere a nivelurilor de IGG, care sunt asociate cu protecția pe termen lung a corpului. În caz de intoleranță alimentară, există o creștere a imunoglobulinelor eIGE - aceștia sunt anticorpi care se formează ca răspuns imediat la o proteină străină pe care sistemul imunitar o recunoaște ca fiind periculoasă pentru organism și reacționează cu efecte secundare precum erupții cutanate, ochi apoși, umflături și multe altele. În alergii, anticorpii IGG au o durată mai mare de acțiune și sunt asociați cu apariția și menținerea inflamației cronice și a infecțiilor, uneori cu simptome persistente de cefalee, balonare, probleme cu pielea, anxietate și depresie. Ele pot declanșa chiar și probleme mai grave, cum ar fi tiroidita lui Hashimoto, diabetul de tip 1, artrita reumatoidă. Simptomele dispar atunci când alimentele respective sunt eliminate. Oamenii de știință numesc microbiomul intestinal al doilea creier, deoarece determină de fapt cum ne simțim, ce mâncăm, cum gândim. Modul în care mâncăm poate afecta modul în care funcționează creierul nostru pe termen lung.
Dacă mâncăm o mulțime de zaharuri și grăsimi, acesta poate avea efecte de durată asupra activității creierului. Intestinele sunt bogate în multe terminații nervoase. Intestinul și creierul nostru sunt mult mai conectate decât orice alt organ.
Cercetătorii de la Universitatea din Los Angeles au descoperit că aproximativ 80% dintre persoanele care au slăbit cu o dietă în doi ani, o recapătă și chiar o cresc. Rezultate similare au fost observate la pacienții cu diabet zaharat de tip 2 (DMT2) la terapia orală care trec la terapia cu insulină din cauza epuizării pancreatice. Două dintre semnele distinctive ale diabetului de tip 2 sunt rezistența la insulină în țesuturile periferice (ficat, mușchi scheletic și țesut adipos) și disfuncția celulei beta secretoare de insulină.
Până nu demult, nu s-a acordat suficientă atenție legăturii dintre intestin, sănătate și supraponderalitate. Se crede că metabolismul nostru este o reflectare (rezultat) a dietei strămoșilor noștri.
Rolul arheobacteriilor este, de asemenea, interesant. Microbiomul intestinal produce vitamine, hormoni și enzime care afectează reacțiile comportamentale și fiziologice din organism. Prin legarea la receptorii din hipotalamus, transmițătorii de oxigen și anorexigenici sunt implicați în reglarea poftei de mâncare.
În 1994, a fost descris produsul genei OB, leptina, care reduce foamea prin semnalarea creierului pentru sațietate. Pe stomacul gol, cantitatea de grelină (produsă în stomac) crește și centrele apetitului din creier sunt afectate de calea vagă. Leptina și grelina joacă un rol foarte important în sistemul de control al echilibrului energetic. Grelina este implicată în reglarea pe termen scurt, iar leptina în reglarea pe termen lung. Pe lângă participarea la metabolismul energetic al organismului, acesta este legat și de greutatea corporală. Leptina este, de asemenea, considerată ca fiind unul dintre factorii din patogeneza ZDT2. În condiții fiziologice, leptina este asociată cu o scădere a sintezei insulinei, iar insulina afectează țesutul adipos și crește sinteza leptinei. S-a constatat că deficiența congenitală de leptină la rozătoare și la oameni duce la obezitate severă. Se ia în considerare și relația sa cu patologia cardiovasculară - prin receptorii din trombocite crește tromboza și afectează elasticitatea vaselor arteriale.
Este cunoscut rolul peptidei 1 de tip incretin glucagon (GLP-1) în reglarea poftei de mâncare. GLP-1 a fost utilizat cu succes în tratamentul ZDT2.
Este secretat de celulele L ale intestinului subțire într-o manieră dependentă de glucoză și stimulează secreția de insulină și scade secreția de glucagon. Efectul său este, de asemenea, de a încetini golirea stomacului și duce la pierderea în greutate prin receptorii din creier și sporește senzația de sațietate, scăderea apetitului și reducerea aportului de energie.
Efecte asupra greutății au fost găsite și pentru dopamină. Nivelurile mai scăzute de dopamină provoacă pofte de mâncare grasă.
O dietă variată și sănătoasă este una dintre cele mai sigure căi pentru un epigenom sănătos - cu metilarea corespunzătoare a genelor și modificări chimice adecvate ale proteinelor care organizează ADN-ul.
- Diabetul - cum să trăiești cu el
- Diabetul și sarcina - cum este dezvăluit
- Diabet - sfaturi și trucuri Doppelherz Bulgaria
- Diabet zaharat și cancer
- Diabetul zaharat la copii și adolescenți