Dr. Lily Grudeva
MU-Varna, Spitalul Universitar „Sf. Marina”, Varna
Enzimele sunt puteri care sunt capabile să îndeplinească diverse funcții în corpul uman. Sunt substanțe chimice de origine naturală. Fiecare organism viu are nevoie de enzime pentru a funcționa. Enzimele digestive sunt cele care facilitează descompunerea chimică a alimentelor în componente moleculare absorbabile mai mici. Reacțiile chimice implicate în procese precum creșterea, respirația, reproducerea, coagularea sângelui, digestia sunt catalizate de enzime.
Corpul nostru conține peste 3.000 de enzime care sunt în mod constant restaurate. Sunt molecule mari de proteine care cresc viteza reacțiilor chimice. Sunt specifice, funcționează cu un singur reactiv și au o structură tridimensională.
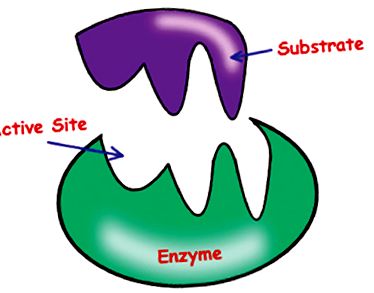
Substratul este un reactiv în reacția enzimatic-catalitică. Această parte a moleculei responsabile de acțiunea catalitică a enzimei este denumită situs activ (Fig. 1).
Figura 1: Locul activ al enzimei
Caracteristicile enzimelor
- Au o activitate catalitică ridicată.
- Sunt foarte specifice.
- Toate enzimele sunt proteine.
- La fel ca proteinele, ele se pot coatulă cu alcool, căldură, acizi concentrați și reactivi alcalini.
Enzimele au un interval optim de pH în care să funcționeze.
Substanțele anorganice cunoscute sub numele de activatori cresc activitatea enzimelor.
Inhibitorii sunt substanțe care reduc activitatea enzimei sau o inactivează.
Inhibitorii competitivi sunt substanțe care se leagă reversibil de situsul activ al enzimei, blocând astfel legarea substratului de enzimă.
Inhibitorii neconcurențiali sunt substanțe care se leagă de orice situs al enzimei, altul decât situsul activ, ceea ce face enzima mai puțin activă sau inactivă.
Clasificarea actuală a enzimelor folosește numele substratului sau tipul de reacție implicat și se termină cu „I”. Un exemplu de „maltoză” - substratul este maltoza. Hidroliza este tipul de reacție hidrolazică.
Enzimele sunt clasificate pe baza reacțiilor care catalizează:
- Transferaze
- Hidrolaze
- Izomeraze
- Ligazi
- Închirieri
Ca structuri proteice, enzimele conțin lanțuri de aminoacizi (AK) legate între ele. Caracteristica lor este determinată de succesiunea aranjamentului AK.
Enzimele sunt extrem de selective, catalizând doar reacții specifice. Cele mai multe dintre ele constau dintr-o parte proteică și o parte neproteică numită cofactor. Partea proteică este cunoscută sub numele de „apoenzimă”. Împreună, apoenzima și cofactorii sunt cunoscuți ca „holoenzimă” (Fig. 2).
Unul dintre cele mai importante roluri ale enzimelor este participarea lor la procesul digestiv. Digestia este un complex de procese care au loc în tractul gastro-intestinal, transformând substanțele chimice complexe care fac parte din alimente în compuși simpli capabili să fie transportați în peretele vascular al corpului. Procesele de transport al substanțelor în mediul intern al corpului se numesc „aspirație” (transport, resorbție).
Organul principal al sistemului digestiv este intestinul subțire. Procesele de digestie și absorbție a nutrienților se încheie practic aici. Conform noțiunilor clasice, procesele de digestie se încheie aproape în totalitate în lumenul negru subțire. În ea, enzimele digestive primite de sucurile pancreatice și intestinale se amestecă cu chimul intestinului. Împreună cu bila biliară, aceste enzime descompun substanțele nutritive în monomeri simpli care sunt absorbiți de peretele intestinal.
Odată cu descoperirea digestiei membranare la începutul anilor 1960 de către Ugolev, s-a dovedit că etapele intermediare și finale ale hidrolizei pentru majoritatea nutrienților au loc de pe suprafața apicală a membranelor celulelor epiteliale intestinale (enterocite). Prin urmare, până de curând, digestia organismelor superioare a fost împărțită în:
- Extracelular.
- Membrană.
- Intracelular.
Digestia începe în cavitatea bucală, datorită amilazei salivare, care este secretată de cele 3 perechi de glande salivare. Amilaza este considerată a fi un „jucător” digestiv major. Amilaza salivară inițiază degradarea inițială a amidonului tratat termic.
Din păcate, este rapid inactivat de suc gastric acid. Etapele inițiale ale hidrolizei proteinelor se realizează în stomac sub influența pepsinei, care atacă unele legături peptidice ale proteinelor. Studii recente la om au arătat prezența lipazei gastrice în stomac. Acesta din urmă hidrolizează acizii grași cu lanț scurt și mediu și este important pentru hidroliza laptelui.
Compoziția alimentelor afectează cantitatea și concentrația sucului gastric. Secreția gastrică este mai mare la consumul de carne, mai mică la consumul de cereale și mai mică la consumul de lapte.
În condiții naturale în timpul digestiei, conținutul gastric acid (pH 1,8-2,2) este evacuat în porțiuni în lumenul duodenului, unde pH-ul este ușor alcalin (pH 7,1-7,6). Acolo, alimentele sunt expuse la scurgerea de enzime din pancreas și vezica biliară. Sucul pancreatic conține bicarbonat de sodiu și diverse enzime digestive, care sunt împărțite în patru grupe: proteolitic, lipolitic, glicolitic și nuclează. Proteazele pancreatice majore sunt secretate sub formă de proenzime-tripsinogen și chimotripsinogen. Acestea din urmă (după activarea în tripsină și chimotripsină) continuă acțiunea pepsinei gastrice.
Enzimele glicolitice, reprezentate de alfa-amilaza pancreatică, descompun amidonul în dextrină și maltoză. Lipaza pancreatică hidrolizează trigliceridele în monogliceride, glicerol și acizi grași.
O parte a enzimelor pancreatice atacă substraturile respective din duoden și lumenul intestinal, iar o altă parte este absorbită pe mucoasa intestinului subțire, unde continuă etapele următoare ale hidrolizei lor. Acțiunea enzimelor proteolitice și glicolitice este în principal în părțile superioare și mijlocii ale intestinului subțire, în timp ce enzimele lipolitice își exercită acțiunea în duoden.
Bila secretată promovează descompunerea lipidelor prin lipază în lumenul duodenului. Bila ajută și la absorbția vitaminelor solubile în grăsimi A, D, E și K.
Etapele inițiale ale hidrolizei au loc în lumenul intestinal subțire, în timp ce etapele intermediare și finale ale hidrolizei, precum și absorbția nutrienților sunt realizate de structurile mucoasei intestinale.
Nutrienții care intră în lumenul negru subțire sunt defalcați parțial de enzimele pancreatice și într-o măsură mai mică de enzimele de suc intestinal. Următoarele etape ale hidrolizei se realizează în mucoasa intestinală. Acesta este locul de acțiune a mai mult de 20 de enzime care finalizează hidroliza tuturor nutrienților. Aceste enzime sunt reprezentate de două grupuri: adsorbite de origine pancreatică și intrinseci-intestinale. Ele diferă prin origine și funcții specifice. Adsorbate sunt în principal endihidrolaze și descompun substanțele nutritive în fragmente mari. Cele intestinale în sine sunt exoenzime și efectuează hidroliza biopolimerilor pre-degradați. Acestea sunt legate permanent de membranele enterocitelor și sunt împărțite în carbohidrate, peptidaze și alte enzime. Carbohidrazele sunt reprezentate de gamma-amilază, lactază, maltază și zaharază.
Digestia proteinelor din alimente începe cu participarea endopeptidazelor (pepsină, tripsină și chimotripsină), continuată datorită exopeptidazelor din sucul pancreatic (carbopeptidaze A și B). În etapele următoare, sunt implicate aminopeptidaze intestinale și oligo- și dipeptidaze enterale sunt incluse în etapele finale ale digestiei. Peptidazele hidrolizează un număr mare de peptide diferite. Numai tetrapeptidazele sunt 160 000. Din acest motiv, se estimează că există între 2-6 peptidaze în mucoasa intestinală a omului, dar au un spectru larg de acțiune.
În timp ce s-a demonstrat că oligo- și dizaharidele își completează hidroliza pe suprafața apicală a enterocitelor, locația exactă a hidrolizei pentru oligo- și dipeptide este încă în discuție. Majoritatea autorilor cred că peptidazele intracelulare nu au nicio semnificație reală în procesul digestiv. Unele dintre ele sunt proenzime, iar altele sunt implicate în catabolismul proteinelor plasmatice. O serie de studii au arătat că glicocalixul apical și suprafața membranelor enterocitare conțin nu mai mult de 10% dipeptidaze, astfel încât locul principal al acțiunii lor optime ar trebui să fie membranele lipoproteice în sine.
Conceptul de localizare intramembranară a unor dipeptidaze, formulat de B. Popov, 1995, este confirmat de structura moleculară modernă a enzimelor de membrană.
Dintre celelalte enzime intestinale intrinseci, monoglicerid lipaza este importantă, care realizează etapele finale ale digestiei pe membrană a trigliceridelor.
Pe lângă mecanismele descrise de absorbție transcelulară a nutrienților în intestinul subțire, există și transport paracelular, care are loc între spațiile intercelulare laterale ale enterocitelor. Metodele moderne demonstrează prezența enzimelor pe suprafața laterală a membranelor enterocitare. Se presupune că în transportul paracelular unii nutrienți sunt în complex cu enzimele corespunzătoare, care sunt implicate în fluxul de apă, intră în spațiile intercelulare și există parțial sau complet hidroliza lor (B. Popov, 1995).
Datorită importanței enzimelor digestive în absorbția nutrienților și a faptului că disponibilitatea acestora este adesea compromisă, adăugarea preparatelor enzimatice poate fi, fără îndoială, utilă.
Suplimentarea enzimatică este utilizată pe scară largă pentru tratarea pancreatitei, a enteropatiei cu gluten, a bolilor metabolice, a obezității, a bolilor inflamatorii intestinale, a sindromului intestinului iritabil etc.
Studiile arată că, în numeroase modele de hrănire cu animale experimentale, suplimentarea cu amestecuri de enzime digestive ajută digestia și absorbția nutrienților și contribuie în cele din urmă la sănătatea generală. La om, sistemele de degradare a nutrienților in vitro au fost dezvoltate cu succes. De exemplu, sa demonstrat că enzima alfa-amilază, care este dominantă în hidroliza amidonului, acționează sinergic cu enzima alfa-glucozidază. De fapt, rata de creștere a hidrolizei glucidelor de până la 10 ori este tipică glicozidazelor, plasându-le printre cele mai bune enzime. Enzima proteolitică bromelaină conținută în extractul brut de ananas demonstrează proprietăți antiinflamatorii, antitrombotice și fibrinolitice, care îi conferă un loc demn de puternic agent fitoterapeutic. La fel ca bromaleina, o altă enzimă găsită în papaya ajută și la digerarea proteinelor. Papaina descompune lanțurile proteice ale cărnii.
Amilaza din mango ajută la descompunerea amidonului în dizaharide. Enzimele găsite în miere (amilază, zaharază și proteaze) ajută la descompunerea zaharozei. Nu trebuie subestimat faptul că în natură există alimente bogate în enzime naturale: mere, caise, cireșe, smochine, struguri, sparanghel, avocado, banane, fasole, sfeclă, broccoli, varză, morcovi, castraveți, ghimbir. Prin urmare, este preferabil consumul zilnic de alimente neprelucrate.
Secretul longevității constă în mecanismele complexe pentru menținerea nivelului zilnic de enzime digestive.
bibliografie:
1. B. Popov, Myths and Truth about Food, Nutrition and Diets, Editura Balanță - 4, 2012.
2. Di Stefano M, Veneto G, Malservisi S și colab. Malabsorbția și intoleranța la lactoză la vârstnici. Scand J Gastroenterol. 2001; 36 (12): 1274-8.
3. Keller J, Layer P. Terapia suplimentării enzimelor pancreatice. Opțiuni Curr Treat Gastroenterol 2003; 6: 369-374.
4. Kelly GS. Bromelain: o revizuire a literaturii și discuții despre aplicațiile sale terapeutice. Altern Med Rev 1996; 1: 243-257.
4. Elkaim, Yuri. „Beneficiile sănătății postului”. Blogul Mănâncă pentru energie. Yuri Elkaim, 22 octombrie 2009. Web. 2 august 2010.
6. Larque E, Sabater-Molina M, Zamora S. Semnificația biologică a poliaminelor dietetice. Nutriție. 2007; 23 (1): 87-95.
7. Carey MC, Hernell O. Digestia și absorbția grăsimilor. Semin Gastroint Dis. 1992; 3: 189–208.
8. Carey MC, Small DM, Bliss CM. Digestia și absorbția lipidelor. Annu Rev Physiol. 1983; 45: 651-677.
9. Mukherjee M. Analiza succintă a lipazelor digestive și metabolice umane. J Mol Catal, enzima B. 2003; 22: 369-376.
10. Birari RB, Bhutani KK. Inhibitori ai lipazei pancreatice din surse naturale: potențial neexplorat. Drug Discov Today. 2007; 12: 879–989.
- Ce alimente sunt bogate în enzime digestive
- Tratament cu usturoi prăjit, care începe să se vindece imediat Cum este magia în stomac
- Medina din Fes - magia Marocului Icarus Press
- Magia numerelor care funcționează cu adevărat mantre pentru bunăstare - Vsyaka Jena
- Magia iaurtului! Încercați această dietă, face minuni