. Doar pentru că puteți cumpăra unele medicamente fără prescripție medicală nu înseamnă că acestea nu pot provoca reacții adverse.
Maninil 3,5 comprimate. 3,5 mg x 30; x 60; x 120/Maninil
Maninil 3,5 comprimate. 3,5 mg x 30; x 60; x 120/Maninil
REZUMATUL CARACTERISTICILOR PRODUSULUI/Maninil 3,5 tabl. 3,5 mg x 30; x 60; x 120 /
1. DENUMIREA PRODUSULUI MEDICAMENTAL;
Maninil® 3,5 mg comprimate
Maninil® 3,5 mg comprimate
2. COMPOZIȚIA CALITATIVĂ ȘI CANTITATIVĂ
Un comprimat Maninil® 3,5 mg conține glibenclamidă 3,5 mg ca substanță activă.
Excipienți
Pentru o listă completă a excipienților, vezi secțiunea 6.1.
3. FORMA FARMACEUTICĂ/Maninil 3.5 tabl. 3,5 mg x 30; x 60; x 120 /
4. DATE CLINICE
4.1 Indicații terapeutice
Diabet zaharat non-insulinodependent (diabet zaharat de tip 2, diabet cu debut la adulți), atunci când controlul metabolic nu poate fi realizat doar cu dieta, activitatea fizică și pierderea în greutate.
Utilizarea acestui medicament nu exclude necesitatea respectării stricte a dietei recomandate de medicul dumneavoastră.
Terapia combinată cu insulină poate fi inițiată la debutul rezistenței secundare. Cu toate acestea, în cazurile de absență completă a secreției de insulină endogenă în diabetul de tip 2, nu se poate aștepta un efect pe termen lung cu terapia combinată cu insulină, cu excepția acțiunii insulinei în monoterapie.
4.2 Doze și mod de administrare
Ajustarea dozei de Maninil® 3,5 mg la diabetici trebuie efectuată numai de către un medic și împreună cu o dietă adecvată. Doza depinde de rezultatele testelor metabolice (glucoză din sânge și urină).
Se recomandă creșterea treptată a dozei la începutul tratamentului sau la trecerea de la un alt medicament antidiabetic oral la Maninil® 3,5 mg. Tratamentul se începe cu o doză de 1,75 mg glibenclamidă pe zi (1/2 comprimat Maninil® 3,5 mg o dată pe zi). Creșteți treptat doza la doza necesară terapeutic la intervale de câteva zile până la o săptămână și cu monitorizarea regulată a zahărului din sânge. Efectul maxim se obține cu 10,5 mg glibenclamidă pe zi (3 comprimate Maninil® 3,5 mg pe zi).
Doza zilnică de până la 2 comprimate Maninil® 3,5 mg poate fi administrată întreagă, cu suficient lichid, o dată dimineața înainte de micul dejun. Dacă doza este de 3 comprimate, acestea trebuie luate 2 comprimate dimineața, 1 seara.
Este important să luați comprimatele la aceeași oră în fiecare zi. Dacă pierdeți o doză, aceasta nu trebuie utilizată mai târziu de 1-2 ore după timpul alocat - este mai bine să renunțați la doză. Următoarea doză se ia la ora obișnuită. Dozele ratate nu trebuie compensate niciodată prin administrarea mai multor comprimate mai târziu. Când luați medicamentul, nu trebuie să săriți peste mese.
Maninil® 3,5 mg poate fi combinat cu insulină, metformină, acarboză și gumă guar.
Deoarece controlul metabolic îmbunătățit are ca rezultat o sensibilitate mai bună la insulină, necesitățile de glibenclamidă pot fi reduse în timpul tratamentului. Pentru a evita hipoglicemia severă, poate fi necesară reducerea rapidă a dozei sau, în cazul dozelor zilnice foarte mici, poate fi necesară oprirea tratamentului.
Durata tratamentului depinde de evoluția bolii și este determinată de medicul curant.
Aplicarea la copii și adolescenți
Deoarece diabetul de tip 2 este rar la adolescenți (MODY), utilizarea Maninil® 3,5 mg la această vârstă este o excepție absolută. La un pacient cu o greutate mai mică de 50 kg, tratamentul se începe cu cea mai mică doză zilnică posibilă de 1,75 mg glibenclamidă zilnic (1/2 comprimat Maninil® 3,5 mg zilnic). În alte cazuri, doza este aceeași ca și pentru adulți. Combinația cu insulina în diabetul de tip 1 este ineficientă.
4.3 Contraindicații/maninil-35-tabl-35-mg-x-30-x-60-x-120 /
Maninil® 3,5 mg nu trebuie luat cu:
• diabet zaharat de tip 1 insulino-dependent;
• rezistență secundară completă la tratamentul cu glibenclamidă;
• comă diabetică și precomă;
• după rezecția pancreasului;
• în tulburările metabolice diabetice (cetoacidoză și antecedente ale acesteia);
• insuficiență renală severă (clearance-ul creatininei 30 ml/min), excreția substanței nedigerate a ambilor metaboliți nu se modifică, iar acumularea se observă numai în cazul insuficienței renale severe.
Biodisponibilitate
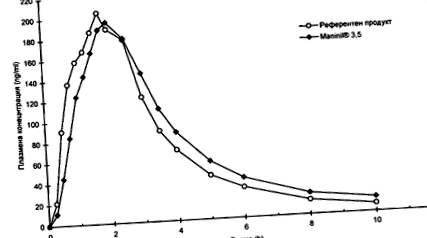
Studiile de biodisponibilitate încrucișate efectuate în 1991 pe 16 subiecți sănătoși au arătat următoarele rezultate comparativ cu medicamentul comparat (valorile sunt prezentate ca mijloace aritmetice și
| Maninil® 1.75 | Un medicament cu care compară | |
| Concentrațiile plasmatice maxime („Cmax”. Ng/ml) | 231,0 (± 71,2) | 234,9 (± 63,8) |
| Timp pentru atingerea concentrației plasmatice maxime (tmax: h) | 21 (± 0,6) | 1,7 (± 0,4) |
| Zona sub curba concentrație/timp (ASC: ng/ml x h) | 759,5 (± 217,4) | 709,3 (± 195,4) |
Este posibil să se demonstreze biodisponibilitatea medicamentelor de investigație.
Valorile concentrațiilor plasmatice medii comparativ cu curba concentrație-timp a preparatului de referință:
Biodisponibilitate Maninil® 3.5
 5.3 Date preclinice
5.3 Date preclinice

Toxicitate acuta
Studiile la animale au arătat că atât toxicitatea acută, cât și cea cronică a glibenclamidei sunt extrem de scăzute. Doza orală de LD50 este mai mare de 15 g/kg greutate corporală la șobolani, șoareci și cobai și mai mare de 10 g/kg greutate corporală la iepuri și câini.
Toxicitate cronică
În studiile de toxicitate cronică, glibenclamida nu a provocat simptome toxice, modificări macroscopice și microscopice ale organelor sau modificări ale parametrilor clinici după expunerea la doze de 0,2 până la 20,0 mg/kg greutate corporală timp de 45 de zile până la 9 săptămâni la pacienții cu șobolani și 18 luni la câini.
Potențial tumogen și mutagen
Nu sunt disponibile date privind potențialul tumorigen al glibenclamidei. Nu a fost identificat niciun potențial mutagen în diferite studii de mutagenicitate in vitro și in vivo (testul Ames, testul micronucleului).
Toxicitate reproductiva
Studiile de fertilitate la șobolani femele și masculi nu au prezentat nicio afectare la doze de până la 15 g/kg greutate corporală. Studiile efectuate la șobolani și iepuri în timpul etapelor sensibile ale organogenezei nu au arătat nicio dovadă a efectelor mutagene, teratogene sau embriotoxice. Efectele embriotoxice la iepuri, șobolani și șoareci, cum ar fi moartea fetală intrauterină și/sau o ușoară creștere a resorbției, au fost observate numai la doze extrem de mari, care depășesc 10.000 de doze active farmacologic la șobolani și șoareci.
6. DATE FARMACEUTICE
6.1 Lista excipienților
Lactoză monohidrat, amidon de cartofi, metilhidroxietilceluloză, siliciu precipitat, stearat de magneziu și colorant E124.
6.2 Incompatibilități
6.3 Perioada de valabilitate
3 ani.
A nu se utiliza după data de expirare înscrisă pe ambalaj!
6.4 Precauții speciale pentru depozitare
A se păstra la temperaturi sub 25 ° C!
A nu se lăsa la îndemâna copiilor!
6.5 Natura și conținutul ambalajului
Cutie de carton cu un blister din film transparent de termoformare din PVC, sigilat cu folie de aluminiu și cu un prospect pentru pacienți (30 sau 60 de comprimate) sau
cutie de carton cu o sticlă de sticlă transparentă, 30 ml, cu dop și prospect pentru pacient (120 comprimate).
Dimensiuni ambalaj - 30, 60 și 120 de comprimate.
7. DEȚINĂTORUL AUTORIZAȚIEI DE PUNERE PE PIAȚĂ
Berlin-Chemie AG (MENARINI GROUP) Glienicker Weg 125 12489 Berlin
Germania
- Tablă trimductală
- Indipam SR 1,5 MG tabl
- Lipopres tabl
- Mezym Forte 3.500 de comprimate
- Metformin Vale tabl
