B. Stoilov
Clinica de Nefrologie și Hemodializă,
SBALDB "Prof. Dr. Ivan Mitev ”, Sofia
Anomaliile congenitale ale sistemului urinar (VAOS) apar cu o frecvență de 3-6 la 1000 de nașteri vii. Ele sunt o cauză principală a bolii renale în stadiul final la copii și sunt, de asemenea, asociate cu un risc crescut de infecții ale tractului urinar, hipertensiune arterială, calculoză și insuficiență renală la pacienții adulți [1]. În centrul EIM se află mecanismele perturbate din nefrogeneză. Acestea pot fi determinate genetic sau pot apărea ca urmare a unor factori externi, cum ar fi diabetul matern, expunerea intrauterină la inhibitori ai ECA și alții. [2]. Se știe că EIA pot afecta unul sau mai multe segmente ale sistemului excretor, formând un fenotip complex. Prin urmare, nu există o clasificare uniformă, iar diagnosticul este dificil. O mutație a unei gene poate avea un efect pleiotrop asupra dezvoltării sistemului excretor și a tabloului clinic și variază de la agenezie/hipoplazie renală la refluxul vezico-ureteral (VUR) [3].
Pe baza embriologiei organelor sistemului urinar, malformațiile congenitale ale acestuia pot fi clasificate ca:
- anomalii în dezvoltarea parenchimului renal;
- anomalii în migrarea rinichilor;
- anomalii în sistemul cavității.
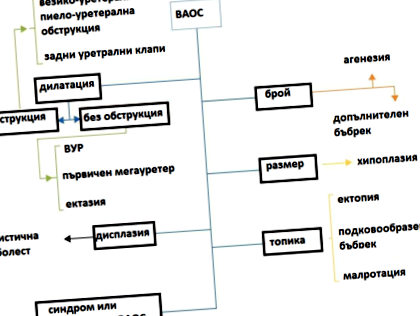
VAOS include un număr mare de boli asociate cu defecte ale morfogenezei sistemului urinar - abateri de la numărul normal, dimensiunea, subiectul rinichilor, dilatarea obstructivă sau neobstructivă a tractului urinar, diverse displazii, inclusiv chisturi ale rinichilor . Unii autori includ polichistoză renală autosomală dominantă/recesivă și nefronoftiză în clasificarea EIA, dar necesită o abordare diagnostică și terapeutică diferită și nu sunt discutate în această lucrare. Convenabil pentru practică este clasificarea prezentată în FIG. 1 [4].
Figura 1. Clasificarea SEE.
În afară de a fi o malformație izolată, BAOS poate face parte dintr-o boală sistemică cu alte manifestări extrarenale, ceea ce complică și mai mult diagnosticul și clasificarea. Unele dintre EIA sunt detectate prenatal prin examinarea cu ultrasunete (morfologie fetală), dar altele și o parte semnificativă a acestuia rămâne nediagnosticată uneori până la pubertate. Manifestarea clinică a acestor boli este foarte variabilă și depinde de tipul și severitatea anomaliei. Unele anomalii, cum ar fi hipoplazia renală și rinichiul ectopic, pot fi găsite accidental la pacienții adulți. Altele - agenezie renală, obstrucție bilaterală în segmentul pielo-ureteral și boală renală chistică, pot fi suspectate prenatal în prezența oligohidramniosului sau postnatal la pacienții cu infecție a tractului urinar, hipertensiune arterială, proteinurie, hematurie, formă calculoasă, palp, FIG. 2.
FIG. 2. Polichistoză renală autosomală dominantă, ecografie prenatală.
Diagnosticul cu ultrasunete ca metodă de screening este de o importanță capitală pentru depistarea precoce a VAOS. O parte semnificativă a acestora este dezvăluită de morfologia fetală - hidronefroză, hidroureter, peretele vezicii îngroșate, rinichi chistic, rinichi mic și/sau displazic sau lipsă, FIG. 3. Descoperirea cu ultrasunete îi îndreaptă pe clinici către urmărirea precoce postnatală a anomalii și a funcției renale, către un tratament în timp util.
FIG. 3. Hidronefroza rinichiului stâng - ecografie prenatală.
În practică, se utilizează alte studii imagistice - CT și RMN [5]. Sunt superioare examinării cu ultrasunete în cazuri de rinichi ectopic, sistem de dublu drenaj, pregătire preoperatorie pentru obstrucție în segmentul pielo-ureteral și chiar în posibile complicații precum pielonefrita, calculoza, neoplasmele. CT (nativ) cu contrast îmbunătățit detectează pietrele la rinichi și nefrocalcinoza. Urografia CT oferă informații valoroase într-un sistem de drenaj dublu (FIG. 4), perfuzie distală [6]. RMN are avantajul că nu se încarcă cu radiații ionizante și oferă o vizualizare mai bună a sistemului de drenaj fără contrast (FIG. 5). Marele dezavantaj este necesitatea sedării pacienților tineri, precum și costul ridicat [7].
FIG. 4. Sistem de drenaj dublu pe stânga, rinichi hipoplastic în dreapta, CT cu contrast.
FIG. 5. Agenezie renală în stânga, RMN.
În ultimii ani, eforturile științifice s-au concentrat pe studiul factorilor ereditari asociați cu această patologie. Diagnosticul genetic molecular este extrem de important deoarece se știe deja că VAOS poate fi doar una dintre manifestările unei boli complexe la un pacient - una care poate fi transmisă de-a lungul generațiilor. Diagnosticul la nivel molecular îl direcționează pe medic către alte simptome uneori dificil de detectat și permite consiliere genetică în timp util. În general, se acceptă, dacă există sau nu manifestări extrarenale, că EIA ar trebui împărțit în două grupuri majore: forme sindromice și nesindromice (izolate) [4].
Formele sindromice ale VAOS
Acest grup include: Sindromul renal-colobom - hipoplazie și colobom renal (PAX2), sindromul branchio-Oto-renal - anomalii auditive și morfologice, displazie renală multicistică (EYA1, SIX1, SIX5), chist renal și sindromul diabetului - diabet zaharat monogen renal (HNF1b), Sindrom Frasier - anomalii oculare, sindactilie, (FRAS1, FREM1, GRIP1), Sindrom Alagille - anomalii ale arborelui biliar, dismorfism facial, malformații cardiace, renale (NOTCH2), sindrom Townes-Brocks - Ana și anomalii renale (SALL1) . Toate acestea sunt rezultatul mutațiilor punctuale ale genelor individuale și au un fenotip complex, cu diferite grade de implicare renală și extrarenală. Un studiu detaliat al terenului genetic al acestor sindroame permite extinderea gamei de gene implicate în patogeneza lor și relevă mecanismele genetice ale dezvoltării renale afectate..
Forme nesindromice ale VAOS
Cercetarea genetică în EIA nesindromice este o adevărată provocare pentru știința modernă. În 1995, primul defect genetic descris pentru a provoca VAOS a fost o deleție care a dus la schimbarea cadrului în PAX2 într-o familie cu colobom al nervului optic, hipoplazie renală și reflux vezicureteral [8].
PAX2 joacă un rol cheie în dezvoltarea rinichilor și mutațiile sale (mai mult de 55 raportate până acum) pot duce la diverse fenotipuri EIA izolate [9].
HNF1β (factorul nuclear hepatocitar 1β), un factor de transcripție implicat în embriogeneza pancreasului, ficatului și rinichilor [10], este a doua genă identificată după detectarea unei mutații heterozigoți la un frate cu chisturi renale și diabet [11, 12 ], și apoi raportat la persoanele cu EIA izolat [13, 14].
Multe studii confirmă că mutațiile din PAX2 și HNF1b sunt cauza BAOS în 15% din toate cazurile. Acest lucru le face de o importanță capitală în screening-ul în scopuri de diagnostic. Mutațiile din PAX2 sunt mai frecvent asociate cu hipodisplazia renală și cele din HNf1b cu chisturile renale. Conform studiilor recente, mutațiile genelor HNF1β și PAX2 sunt mai puțin frecvente decât în trecut, deoarece în studiile anterioare au fost selectați pacienții cu CKD în mare parte și cu anomalii renale severe, de aceea au fost excluse formele mai ușoare.
O abordare nouă și promițătoare în genetica VAOS este varianta numărului de copii (CNV) sau analiza variantelor numărului de copii. Dezvoltarea rinichilor și a tractului urinar la oameni este deosebit de sensibilă la numărul de variante genetice [15, 16, 17], iar defectele genomice structurale apar din ce în ce mai mult ca o cauză importantă a EIA, explicând peste 16% din cazuri. De exemplu, microdelecțiile din cromozomul 17q12 (care conține gena HNF1β) au fost descrise ca mutații de novo la pacienții cu BAOS cu sau fără diabet zaharat [18].
In concluzie
Eforturile de diagnostic la pacienții cu VAOS, pe lângă metodele standard de imagistică și biochimice, ar trebui să se concentreze pe: În primul rând, o căutare aprofundată a simptomelor/sindroamelor extrarenale specifice. În al doilea rând, atent și complet luat istoria familiei. Și al treilea - consiliere genetică.
- Hipoglicemia în diabetul zaharat infantil - cazuri clinice și comportament Pediatrie practică
- Culoarea iasomiei - calmează sistemul nervos și acționează asupra răcelii și gripei - NaturaChoice Online
- Metodele chirurgicale moderne salvează pacienții cu picior diabetic
- Amigdalectomie - tehnici chirurgicale de înaltă tehnologie Pediatrie practică
- Metode moderne de control în creșterea ovinelor