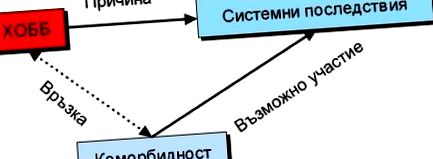
Boala pulmonară obstructivă cronică (BPOC) și astmul bronșic sunt boli pulmonare care afectează structura și funcția pulmonară. În plus față de plămâni, acestea sunt asociate cu efecte semnificative (consecințe) în organele îndepărtate de acestea. 1 Au fost raportate o serie de boli comorbide în BPOC și astm. 2, 3 Limita dintre efectele sistemice și bolile comorbide nu este clar definită. Potrivit lui Rabe, efectele sistemice sunt o consecință directă a bolii, sugerând o relație cauză-efect, iar comorbiditatea este o coincidență epidemiologică a altor boli cu BPOC (Fig. 1). 4
figura 1. Consecințele sistemice ale BPOC 4 .
Efecte sistemice/comorbiditate în BPOC
Bolile comorbide variază în diferite studii (Tabelul 1). 3
tabelul 1. BPOC și comorbiditate (%)
BCV - boli cardiovasculare; GI - tulburări gastro-intestinale
Van Manen și colab. au constatat că mai mult de 50% din 1.145 de pacienți cu BPOC au avut una sau două afecțiuni comorbide, 15,8% au avut trei sau patru și 6,8% au avut cinci sau mai multe boli. 5 Crisafulli și colab. au examinat 2962 de pacienți și au găsit la 51% dintre aceștia cel puțin o boală cronică adăugată la BPOC. 6 Bolile metabolice (hipertensiune sistemică, diabet și/sau dislipidemie) și bolile cardiace (insuficiență cardiacă cronică și/sau boli coronariene) sunt cele mai frecvent raportate combinații comorbide (61% și respectiv 24%). Kessler R și colab. după un interviu cu 2150 de pacienți cu BPOC (gradul III-IV conform GOLD) au constatat următoarele afecțiuni comorbide: hipertensiune arterială -42,8%, boli cardiovasculare - 19,6%, cardiopatie ischemică - 14,3%, diabet - 13,6%, osteoporoză - 10,9%, insuficiență cardiacă stângă - 9,3%, depresie - 8,6%, sindrom metabolic - 8,5%, apnee obstructivă în somn - 7,7% și carcinom (localizare în afara plămânilor - pacienții cu cancer pulmonar au fost excluși din studiu) - 6,1%. 7
Potrivit lui Rabe, consecințele sistemice ale BPOC sunt slăbiciunea musculară, decondiționarea, bolile cardiovasculare, modificările de greutate, depresia/anxietatea și mortalitatea. 4 Comorbiditatea BPOC include boli cardiovasculare, diabet de tip II, depresie/anxietate, anemie, GERD, tulburări endocrine, slăbiciune musculară progresivă, scăderea densității osoase.
Potrivit P.J. Barnes și B.R. Manifestarea sistemică Celli și comorbiditatea în BPOC includ următoarele condiții 8: epuizare musculo-scheletică, cașexie - pierderea masei corporale active, cancer pulmonar (celule mici, celule non-mici), hipertensiune pulmonară, insuficiență cardiacă ischemică - boală cardiacă endotelială - anemie infarct endocardic, diabet, sindrom metabolic, apnee obstructivă în somn și depresie.
Comorbiditatea pare, de asemenea, să afecteze supraviețuirea pacienților cu BPOC (Tabelul 2). 3 Unele studii de mortalitate au arătat că un pacient cu BPOC este mai probabil să moară din cauza unei afecțiuni comorbide decât din BPOC. Într-un studiu canadian realizat de Huiart și colab. boala cardiovasculară a fost o cauză de deces mai frecventă decât BPOC (37,6% față de 14,3%). 9 În BPOC ușoară până la moderată, pentru fiecare reducere de 10% a FEV1, mortalitatea cardiovasculară crește cu aproximativ 28%, iar evenimentele non-fatale cresc cu aproximativ 20%. Pacienții cu BPOC ușoară sunt mai predispuși să moară din cauza unei cauze cardiovasculare decât din cauza insuficienței respiratorii. 10 În alte studii, BPOC a fost principala cauză de deces. În studiul TORCH, 35% dintre pacienți au murit din cauza bolilor pulmonare, 27% din cauza bolilor cardiovasculare, 21% din cauza cancerului și 17% din alte boli. 11, 12 Motivele acestor diferențe sunt probabil selecția pacienților și severitatea bolii (Tabelul 2). 3
masa 2. Cauze raportate de deces la pacienții cu BPOC.
Autor
Pacienții cu BPOC au murit
Motivul
BPOC (%)
Motivul
GCC * (%)
Motivul
neoplazie (%)
Motivul
alții
respirator (%)
Tabelul 3. Boli cronice majore la pacienții cu BPOC și consecințele lor potențiale.
Boala extrapulmonară
Consecințe posibile la pacienții cu BPOC
Comorbiditatea în astm. Condițiile comorbide în astm au fost studiate într-o măsură mult mai mică decât în BPOC. Se crede că acestea contribuie la un control slab al astmului. 14 Astmul este cel mai frecvent asociat cu rinosinuzita, boala de reflux gastroesofagian (GERD), tulburările psihologice, infecțiile cronice și apneea obstructivă în somn (Fig. 2).
Figura 2. Comorbiditatea în astm. GERD - boala de reflux gastro-esofagian; AGA - apnee obstructivă în somn; ABPA - aspergiloză bronhopulmonară alergică 14
Mecanisme potențiale care conduc la sechele sistemice/comorbiditate în BPOC
Întrebarea principală este dacă bolile comorbide observate în BPOC sunt rezultatul unor factori de risc comuni (îmbătrânire, fumat și predispoziție genetică) sau sunt consecințele, cel puțin parțial, ale inflamației pulmonare și/sau sistemice care caracterizează BPOC. 13 Sunt discutate mai multe teorii, dintre care cele mai importante sunt cele ale inflamației sistemice, scăderii activității fizice, hipoxiei tisulare. În multe cazuri, există legături patogenetice și fiziopatologice comune între diferitele ipoteze. Până în prezent, mecanismele potențiale au fost studiate mai bine în BPOC decât în astmul bronșic.
Inflamația sistemică în BPOC
O serie de studii au arătat că inflamația sistemică în BPOC se caracterizează prin creșterea numărului de celule albe din sânge, proteine de fază acută (proteină C reactivă, CRP, fibrinogen, amiloid seric A, SA-A și proteină surfactan D, SP-D) și citokine.interleukina 6, IL-6, factor de necroză tumorală alfa, TNF-α, interleukina 1 beta, IL-1β, interleukina 8, IL-8 și adipokină, o citokină derivată din celulele adipoase). 8, 15 Inflamația sistemică de grad scăzut este observată și în alte afecțiuni cronice: insuficiență cardiacă cronică, boală arterială periferică, boală coronariană, obezitate, toleranță afectată la glucoză și diabet. 16 Originea inflamației sistemice este neclară. Există două puncte de vedere: unii oameni de știință consideră că inflamația sistemică este rezultatul unei „revărsări” a răspunsului inflamator pulmonar în circulația sistemică și a dezvoltării consecințelor sistemice/comorbidității (Fig. 3). Alții cred că pneumonia din BPOC face parte dintr-o inflamație „sistemică” care afectează multe organe. 8
Figura 3. Efecte sistemice și comorbiditate în BPOC 8 .
Roy și colab. nu s-a găsit nicio corelație între neutrofilele sputei și serul hs-CRP. Aceste date sugerează că inflamația sistemică în BPOC este mai mult decât un marker al inflamației locale (pulmonare). 17 Există o reglementare și o disociere independentă între cele două tipuri de inflamație (locală și sistemică). 16
Inflamația sistemică în astm
Proteina surfactant D (SP-D), inflamația pulmonară și sistemică în BPOC și astm. SP-D este o glicoproteină din familia colectinelor și este secretată în principal de pneumocitele de tip II. 8 Prin urmare, este un marker pulmonar specific. Valorile crescute ale SP-D serice pot fi utilizate ca marker neinvaziv pentru a evalua permeabilitatea și integritatea membranei alveolare-capilare. Valorile SP-D au fost reduse în spălarea bronhoalveolară și crescute în ser la pacienții cu BPOC comparativ cu controalele sănătoase. 22, 23 Nivelurile serice de SP-D sunt, de asemenea, crescute în astm și cresc odată cu expunerea la alergeni. Aceștia s-au corelat semnificativ cu unii parametri inflamatori din spută (proteină cationică eozinofilă, ECP și număr de eozinofile). Aceste date susțin teoria „spill-over” în BPOC și astm. Mecanismul prin care SP-D intră în circulație este neclar. Ipoteza conform căreia inflamația sistemică este rezultatul „revărsării” nu a fost încă dovedită. 25
Activitatea fizică și obezitatea în astm
O serie de studii au arătat o activitate fizică redusă în astm. 26 Studiul ECRHS-II a constatat că activitatea fizică (inactivitatea) este un predictor al hiperreactivității bronșice la adulți. În același timp, există o legătură între nivelurile CRP și hiperreactivitatea bronșică. 27 O meta-analiză a șapte studii (333.102 pacienți) a arătat că pacienții supraponderali (IMC ≥ 25) au avut un risc crescut cu 50% de a dezvolta astm. 28
Activitatea fizică și obezitatea în BPOC. Activitatea fizică este, de asemenea, redusă în BPOC. 26 Activitatea fizică scade la pacienții cu BPOC odată cu creșterea severității bolii (evaluată prin etapele GOLD și BODE). Mai mult, scăderea activității fizice este asociată cu valori mai mari ale hs CRP și disfuncție ventriculară stângă. 29 Activitatea fizică regulată reduce riscul unor niveluri ridicate de TNF-α și CRP circulante. 30 Waltz și colab. au studiat 170 de pacienți cu BPOC (stadiul I-IV conform GOLD) și au constatat prezența sindromului metabolic în aproximativ 50% din cazuri. 31 Criteriile utilizate pentru sindromul metabolic sunt circumferința taliei: bărbați ≥ 94 cm; femei ≥ 80 cm plus doi din fiecare dintre următorii patru factori: trigliceride ≥ 150 mg/dL sau tratament specific pentru această tulburare lipidică; Colesterol HDL 31 Sindromul metabolic din BPOC este asociat cu o activitate fizică mai scăzută și niveluri mai ridicate de CRP și IL-6. 31 Potrivit lui Ten Hacken, aceste date sugerează că inflamația sistemică în stadiile incipiente ale BPOC este mediată de obezitate și sindromul metabolic, iar în etapele ulterioare de activitatea fizică redusă. 36
Rolul țesutului adipos pentru inflamația sistemică. Scăderea activității fizice, obezitatea și inflamația sistemică sunt probabil factori de risc importanți pentru starea de sănătate a pacienților cu astm și BPOC. 26 Rolul important al țesutului adipos abdominal visceral în sindromul metabolic a fost discutat recent. 26 Nu este un țesut inert, ci un organ secretor important (leptină, adiponectină), care este implicat în reglarea multor procese patologice. IL-6, una dintre citokinele proinflamatorii importante, poate fi produsă de țesutul adipos abdominal. În FIG. 4 arată schematic relația dintre obezitate, inflamație sistemică de grad scăzut și boli cardiovasculare. 32 Săgețile roșii reflectă efectul fumatului. Obezitatea abdominală și fumatul sunt asociate cu rezistența la insulină, stresul oxidativ și niveluri crescute ale diferitelor adipocitokine și markeri inflamatori care duc la disfuncții endoteliale și la dezvoltarea bolilor cardiace ischemice.
Figura 4. Obezitate, inflamație sistemică și boli cardiovasculare 32 .
Deoarece nivelurile crescute de CRP la persoanele tinere sănătoase sunt asociate cu o scădere mai rapidă a funcției pulmonare, este firesc ca activitatea fizică redusă și obezitatea să fie factori de risc independenți pentru dezvoltarea astmului și a BPOC. O schemă ipotetică a corelațiilor complexe dintre activitatea fizică redusă, obezitatea, inflamația sistemică și consecințele acestora pentru dezvoltarea bolilor pulmonare obstructive sunt prezentate în Fig. 5. Inflamarea sistemică de grad scăzut poate fi legătura dintre factorii de risc cunoscuți pentru boala pulmonară obstructivă și comorbiditatea. Interacțiunea dintre acești factori rămâne neclară în multe privințe. 26
Figura 5. Schema hipotetică a relațiilor complexe dintre activitatea fizică, obezitatea, inflamația sistemică și boala pulmonară obstructivă. Săgețile continue indică defecte pozitive, iar săgețile punctate indică efecte negative. BHR - hiperreactivitate bronșică; BCV - boli cardiovasculare 26 .
Hipoxie tisulară. Klausen și colab. a constatat că hipoxemia (4 zile la 4350 m deasupra nivelului mării) a crescut semnificativ nivelul IL-6 la voluntarii sănătoși. 33 Takabatake și colab. a constatat că nivelurile de TNF-α au fost semnificativ mai mari la pacienții cu BPOC și în același timp s-au corelat semnificativ cu severitatea hipoxemiei arteriale. Aceste rezultate ne conduc la ipoteza că hipoxemia arterială la pacienții cu BPOC este asociată cu activarea sistemului TNF-α in vivo. Dacă această ipoteză este confirmată, supraviețuirea îmbunătățită a pacienților care primesc oxigenoterapie la domiciliu ar putea fi legată de efectul oxigenului asupra inflamației sistemice.
Mesaje pentru practica clinică
Fabbri și Rabe au sugerat recent ca BPOC să fie considerată o componentă a unui sindrom numit „sindrom inflamator sistemic cronic” (CHD). Pacientul ar trebui să fie diagnosticat cu acest sindrom dacă există trei sau mai multe criterii din cele prezentate în tabel. 4. 35
Tabelul 4. Sindromul inflamator sistemic cronic.
| Vârsta> 40 de ani. |
| Fumatul> 10 pachete/an. |
| Simptome și afectarea funcției pulmonare corespunzătoare BPOC |
| Insuficiență cardiacă cronică |
| Sindromul metabolic |
| CRP crescut |
Fabbri și colab. consideră, de asemenea, că diagnosticul și evaluarea severității BPOC pot fi foarte mult influențate de prezența bolii comorbide. La orice pacient cu BPOC, diagnosticul minim trebuie să includă examinarea funcțională a respirației, evaluarea neinvazivă a funcției ventriculare stângi (ecocardiografie și peptidă natriuretică cerebrală, BNP), zahăr din sânge și CRP. 36
Concepțiile moderne ale comorbidității BPOC ne oferă noi posibilități terapeutice. De exemplu, o serie de studii au arătat că terapiile care vizează bolile cardiovasculare (statine și beta-blocante) reduc mortalitatea prin BPOC. 13 Pe de altă parte, corticosteroizii inhalatori reduc riscul de infarct miocardic acut în BPOC. 37 Aceste observații necesită confirmare în studiile controlate randomizate de mari dimensiuni.
Informațiile științifice acumulate în ultimii ani par să ne schimbe percepțiile despre BPOC și astm. Cunoștințele noastre despre aceste boli intră într-o a treia fază după prima „fază de obstrucție bronșică” și a doua „fază de pneumonie”. Ceea ce va fi numită această a treia fază rămâne neclar.
Literatură
- Nutriția în cancerul de colon, plămâni, pancreas și stomac
- Aceste alimente întăresc plămânii și protejează împotriva bolilor respiratorii (FOTO) - Curios
- Sarcoidoza plămânilor - diagnostic
- Alimentele care ne ajută să ne curățăm plămânii - Sănătoși
- Silicoza - o boală fibroasă a plămânilor